Documente Academic
Documente Profesional
Documente Cultură
Complecsi-M L V (Curs4)
Încărcat de
adrianaTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Complecsi-M L V (Curs4)
Încărcat de
adrianaDrepturi de autor:
Formate disponibile
C O M B I N AT I I C O M P L E X E
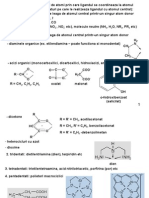
Partile componente ale unei combinatii complexe sunt: 1. Sfera interna de coordinare: - atom central (ion central) molecule anorganice sau organice - liganzi anioni sau cationi (liganzi monodentati liganzi cu un singur atom coordinativ; liganzi bidentati cu mai multe centre coordinative... liganzi polidentati 2. Sfera externa de coordinare Complecsi cu sfera neutra (complecsi neutri : [Ni(CO)4] ; [Cr(NH3)3Cl3] sfera anionica : K3[Co(CN)6] ; K3[Fe(SCN)6] sfera cationica : [Co(NH3)5Cl]Cl2 ; [Coen2Cl2]Cl Principalele caracteristici ale combinatiilor complexe: - tind sa-si mentina interiatea in solutie - atat atomul central cat si liganzii pot exista independent Comparati : K2[HgCl4] (combinatie complexa) cu 2 KCl .MgCl2 (sare dubla) Nomenclatura:: [Pt(NH3)3(NO2)Cl2] Br bromura de dichloronitrotriammine Pt(IV) bromide [(Ph3P)3RhCl] cloro tris(triphenylphosphine)rhodium(I) K3[Fe(CN)6] - hexacyanoferrate(III) de potasiu Stbiliti formulele urmatorilor complecsi: a. cis-diaquodichloroplatinum(II); b. diamminetetrakis(isothiocyanato)chrom(III) si denumiti [Cr(edta)]- si trans-[PtCl2(NH3)4]2
Combinatii Complexe
Legatura chimica in combinatiile complexe Premizele metodei legaturii de valenta
1. legatura metal-ligand este o legatura coordinativa in care atomul central (ionul central) are orbitali liberi (acestia sunt orbitalii interiori (n-1)d si cei exteriori ns, np) iar liganzii au perechi de electroni neparticipante la legatura (atomul central est acceptor si ligandul este donor) 2. orbitalii liberi ai atomului central sunt orbitali hibrizi cu aceeasi energie N.C 2 3 4 4 5 6 7 8 Hibridizare sp,ds,dp sp2, d2s sp3, d3s dsp2, d2sp dsp3, d3sp d2sp3, sp3d2 d3sp3,d5sp d5sp2 Poliedru de coordinare Linear Triunghiular plan Tetraedricl (Td) Plan-patrat Bipiramida trigonalaod (B.P.T) Octaedru (Oh) Bipiramida pentagonalad (P.B.P) cubic
3. orbitalii interiori ocupati ai atomului central (care nu sunt hibrizi) nu formeaza legaturi coordinative dar formeaza legaturi retrodonoare 4. prin coordinare, configuratiile electronice ale atomului ceentral pot fi : - configuratie de gas inert complecsii cei mai stabili - configuratii care contin mai putini electroni decat gazul inert complecsi cu stabilitate mai mica configuratii cu mai multi electroni decat ai gazului inert complecsi cu stabilitatea cea mai mica Pauling a stabilit criteriul magnetic al tipului de legatura si al tipului de stereochimie in combinatiile complexe: - un complex paramagnetic (spin inalt) este ionic pentru N.C. = 4 sunt Td - un complex diamagnetic (spin jos) este covalent ; pentru N.C. = 4 complecsii sunt plan-patrati Intrebari 1. De ce acest criteriu nu este general valabil? Vezi complecsii cu atom central cu configuratii d1 d3 2.Comparati stereochimica complecsilor cu N.C. = 4 [NiCl4]2- , [Ni(CN)4]2-, [Ni(CO)4] 3.Explicati stabilitatea metalcarbonililor: [Cr(CO)6], [Fe(CO5], [Ni(CO4]
Combinatii Complexe
S-ar putea să vă placă și
- 13 - 14 Chimie Anorganica I-Curs 13+14Document35 pagini13 - 14 Chimie Anorganica I-Curs 13+14Razvi RazvanÎncă nu există evaluări
- Chimie Anorganica I-Curs13+14Document34 paginiChimie Anorganica I-Curs13+14Anca MorarÎncă nu există evaluări
- 2 Combinatii ComplexeDocument38 pagini2 Combinatii ComplexeAndriana Avram100% (1)
- 14 - Curs14-Chimie Anorganica PDFDocument41 pagini14 - Curs14-Chimie Anorganica PDFMoni Valinschi100% (2)
- 5 Prelegere - 2021 47960Document21 pagini5 Prelegere - 2021 47960CorneliaBelescuÎncă nu există evaluări
- Combinaţii Complexe - ChimieDocument2 paginiCombinaţii Complexe - ChimieDiana MariaÎncă nu există evaluări
- Proiect ChimiemartinDocument3 paginiProiect Chimiemartincio_andreyÎncă nu există evaluări
- Combinatii ComplexeDocument11 paginiCombinatii ComplexeOanaSârbu0% (1)
- Compusi CoordinativiDocument20 paginiCompusi CoordinativiEugenia Ceban83% (6)
- Obtinerea Combinatii ComplexeDocument2 paginiObtinerea Combinatii ComplexeVic AlÎncă nu există evaluări
- Curs Reacţii ComplexareDocument6 paginiCurs Reacţii ComplexareDragoș GoiaÎncă nu există evaluări
- Chimia CoordinativăDocument47 paginiChimia CoordinativăPetru BulmagaÎncă nu există evaluări
- Curs 10Document6 paginiCurs 10Deea AndreeaÎncă nu există evaluări
- Reactii Cu Formare de Combinatii ComplexeDocument6 paginiReactii Cu Formare de Combinatii ComplexeIulianÎncă nu există evaluări
- Compusi CoordinativiDocument115 paginiCompusi CoordinativiAndreiCondreaÎncă nu există evaluări
- CMT 05Document30 paginiCMT 05Florin AlexandruÎncă nu există evaluări
- Curs 8 ComplecsiDocument30 paginiCurs 8 ComplecsiCristi BacaluÎncă nu există evaluări
- Compusi ComplecsiDocument67 paginiCompusi ComplecsiIrinaMadanÎncă nu există evaluări
- Metale TranzitionaleDocument30 paginiMetale TranzitionaleAndreea Ioana100% (1)
- Cursul 7Document14 paginiCursul 7anarbkÎncă nu există evaluări
- Legatura CovalentaDocument47 paginiLegatura CovalentaRadu AndreiÎncă nu există evaluări
- Curs 11 SemIIDocument11 paginiCurs 11 SemIIAdrian m/Încă nu există evaluări
- Combinatii ComplexeDocument20 paginiCombinatii ComplexeIolanda NourÎncă nu există evaluări
- LI Clasificarea LiganzilorDocument9 paginiLI Clasificarea LiganzilorPalamari DanielaÎncă nu există evaluări
- ChimieDocument7 paginiChimiemarinacoolÎncă nu există evaluări
- Reactii de ComplexareDocument17 paginiReactii de ComplexareLucian SuciuÎncă nu există evaluări
- Biochimie Curs 1 Si 2Document14 paginiBiochimie Curs 1 Si 2mijmasuÎncă nu există evaluări
- Elementele Din Grupa 15 - Chimie AnorganicaDocument55 paginiElementele Din Grupa 15 - Chimie AnorganicaAlina TanaseÎncă nu există evaluări
- Combinatii ComplexeDocument17 paginiCombinatii Complexealamanca80% (15)
- Material de Sprijin Al Elevului Pentru Susținerea Învățării În Ritm PropriuDocument3 paginiMaterial de Sprijin Al Elevului Pentru Susținerea Învățării În Ritm PropriueuÎncă nu există evaluări
- Curs 8 ComplecsiDocument30 paginiCurs 8 ComplecsiCorina Ilinca RăducuÎncă nu există evaluări
- Structura Invelisului ElectronicDocument21 paginiStructura Invelisului ElectronicMaria VelicofÎncă nu există evaluări
- Structura Invelisului de ElectroniDocument21 paginiStructura Invelisului de ElectroniMartaGulaciÎncă nu există evaluări
- Grile Chimie Anorganica 2012 SEM 2 Fara PasswordDocument77 paginiGrile Chimie Anorganica 2012 SEM 2 Fara PasswordMarian Pavel50% (2)
- Reactii de ComplexareDocument16 paginiReactii de ComplexareIoana AlexandraÎncă nu există evaluări
- Clorura de SodiuDocument7 paginiClorura de SodiuIrimia Oana-CarmenÎncă nu există evaluări
- Curs 2,3 Geometrii, Izomerie CCDocument36 paginiCurs 2,3 Geometrii, Izomerie CCSorin MiuÎncă nu există evaluări
- Combinatii ComplexeDocument5 paginiCombinatii ComplexePica LaurentiuÎncă nu există evaluări
- Curs 10 Compusii Organici Ai CarbonuluiDocument10 paginiCurs 10 Compusii Organici Ai CarbonuluiGabriela AlmajanuÎncă nu există evaluări
- Referat Combinaţii ComplexeDocument2 paginiReferat Combinaţii ComplexeAlina DraganÎncă nu există evaluări
- CMT Curs 09 PrintDocument17 paginiCMT Curs 09 PrintMarinelaÎncă nu există evaluări
- CMT-curs 06 - 2013Document20 paginiCMT-curs 06 - 2013Bianca OlteanuÎncă nu există evaluări
- DwfedfDocument9 paginiDwfedfAndra Ch123Încă nu există evaluări
- Hidrocarburi Aromatice PolinucleareDocument75 paginiHidrocarburi Aromatice Polinuclearepetreos100% (1)
- Reactii de ComplexareDocument6 paginiReactii de ComplexareIvan AndreiÎncă nu există evaluări