Documente Academic
Documente Profesional
Documente Cultură
Apa - Caracterizare Generala
Încărcat de
Julia0%(1)0% au considerat acest document util (1 vot)
272 vizualizări1 paginăApa caracteristici generale
Titlu original
apa - caracterizare generala
Drepturi de autor
© © All Rights Reserved
Formate disponibile
DOCX, PDF, TXT sau citiți online pe Scribd
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentApa caracteristici generale
Drepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca DOCX, PDF, TXT sau citiți online pe Scribd
0%(1)0% au considerat acest document util (1 vot)
272 vizualizări1 paginăApa - Caracterizare Generala
Încărcat de
JuliaApa caracteristici generale
Drepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca DOCX, PDF, TXT sau citiți online pe Scribd
Sunteți pe pagina 1din 1
Apa – caracterizare generala
Apa (monoxidul de dihidrogen) este un compus anorganic polar cu formula
chimică H2O. Molecula sa este formată prin combinarea a doi atomi de hidrogen și
un atom de oxigen, fiind astfel oxidul hidrogenului și cea mai simplă hidrură
de calcogen. Este de departe cel mai studiat compus chimic, astfel că unii
biochimiști numesc apa ca fiind un „solvent universal”, pentru abilitatea sa de a
dizolva multe substanțe.[1][2] Această proprietate îi dă apei posibilitatea să fie și
„solventul lumii vii”.[3] Este singura substanță comună care există sub toate cele trei
forme de agregare în natură: solidă (gheață), lichidă (apă) și gazoasă (abur).[4]
Moleculele de apă formează legături de hidrogen între ele, fiind puternic polare.
Polaritatea moleculei de apă permite separarea în ioni și formarea de legături
puternice cu alte substanțe polare, precum alcoolii și acizii, astfel dizolvându-le.
Legăturile de hidrogen sunt motivul pentru multe proprietăți speciale ale apei, precum
faptul că forma sa solidă este mai puțin densă decât forma sa lichidă, punctul de
fierbere de 100 °C este relativ mare pentru masa sa moleculară mică,
și capacitatea termică, care este ridicată.
Apa este o substanță amfoteră (numit și amfolit), ceea ce înseamnă că poate fi
atât acid, cât și bază, adică produce ionii H+ și O- prin ionizare (proces denumit
și autoprotoliză).
S-ar putea să vă placă și
- Apa CristalinaDocument21 paginiApa CristalinaLili TigerÎncă nu există evaluări
- Apele de Suprafață Ale Eurasiei.: ObiectiveDocument21 paginiApele de Suprafață Ale Eurasiei.: ObiectiveValentina PaduraruÎncă nu există evaluări
- Efectele CaliriiDocument2 paginiEfectele CaliriiVictoria Popa-CondreaÎncă nu există evaluări
- Râul RăutDocument5 paginiRâul Răutanon_411215445Încă nu există evaluări
- Sub Cușma Lui Guguță I JocDocument38 paginiSub Cușma Lui Guguță I Jocolesea roscaÎncă nu există evaluări
- Maladii Ereditare Și Profilaxia LorDocument30 paginiMaladii Ereditare Și Profilaxia LorAndrei TepordeiÎncă nu există evaluări
- Semiologia Aparatului Digestiv Cap.1Document15 paginiSemiologia Aparatului Digestiv Cap.1Florin Leasu50% (2)
- Ochiul de Sub Copertă 1 PDFDocument124 paginiOchiul de Sub Copertă 1 PDFMargarita Rotari-BobocÎncă nu există evaluări
- Protectia Dezvoltarea Si Conservarea Oceanului PLanetarDocument10 paginiProtectia Dezvoltarea Si Conservarea Oceanului PLanetarFlorin Zăinescu100% (1)
- Superlative AsiaticeDocument3 paginiSuperlative AsiaticeGabi Ignat100% (1)
- ClorulDocument9 paginiClorulEmőke VargaÎncă nu există evaluări
- Moldova Ţară EuropeanăDocument13 paginiMoldova Ţară EuropeanăDiana Alexandru CiuntuÎncă nu există evaluări
- Sistemul Digestiv+sistemul ExcretorDocument23 paginiSistemul Digestiv+sistemul ExcretorBeatrice StefanescuÎncă nu există evaluări
- Rolul Biologic Al CalciuluiDocument1 paginăRolul Biologic Al CalciuluiAlina CojocaruÎncă nu există evaluări
- Incluziuni CelulareDocument4 paginiIncluziuni CelulareveronicaÎncă nu există evaluări
- Substante Chimice Folosite in Industria MedicamentelorDocument11 paginiSubstante Chimice Folosite in Industria Medicamentelorcostel_80Încă nu există evaluări
- Curiozitati Despre FicatDocument2 paginiCuriozitati Despre FicatLuminita LumyÎncă nu există evaluări
- Efectele Biologice Ale Radiatiilor Radioprotectia.Document11 paginiEfectele Biologice Ale Radiatiilor Radioprotectia.ion_zlotea50% (2)
- Importanta Clorului in OrganismDocument5 paginiImportanta Clorului in OrganismJulianaÎncă nu există evaluări
- Glanda Suprarenala - Histologie, Histogeneza - Elena CojocaruDocument24 paginiGlanda Suprarenala - Histologie, Histogeneza - Elena Cojocaruirina22_alessÎncă nu există evaluări
- Diafragma 2Document4 paginiDiafragma 2Marinela MureaÎncă nu există evaluări
- Prezentare SULFDocument11 paginiPrezentare SULFClaudiuÎncă nu există evaluări
- Magneziu Si Compusii Lui, Magneziul in OrganismDocument15 paginiMagneziu Si Compusii Lui, Magneziul in OrganismDaniela DanaÎncă nu există evaluări
- Orientarea LiliecilorDocument3 paginiOrientarea LiliecilorAsiral DecoÎncă nu există evaluări
- FumatulDocument6 paginiFumatulAlexandraÎncă nu există evaluări
- Lucrare de Laborator NR 2Document12 paginiLucrare de Laborator NR 2Vlad OfticiÎncă nu există evaluări
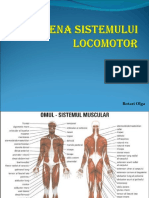
- Igiena Sistemului LocomotorDocument18 paginiIgiena Sistemului LocomotorOlga RotariÎncă nu există evaluări
- MolusteleDocument13 paginiMolusteleАндрей МитрозорÎncă nu există evaluări
- Acidul AzoticDocument6 paginiAcidul AzoticEugenia Cujba100% (2)
- Importanta Muschilor (Planta)Document1 paginăImportanta Muschilor (Planta)AdrianCiolpanÎncă nu există evaluări
- Caracteristica Claselor de VertebrateDocument8 paginiCaracteristica Claselor de Vertebrateliudmila boiciucÎncă nu există evaluări
- Miscarea Sistemul LocomotorDocument9 paginiMiscarea Sistemul LocomotorAdam Denisa MihaelaÎncă nu există evaluări
- Legatura IonicaDocument7 paginiLegatura IonicaDomnica SapojnicÎncă nu există evaluări
- Insuficienta Și Excesul Metalelor În Corpul UmanDocument9 paginiInsuficienta Și Excesul Metalelor În Corpul UmanNaleaÎncă nu există evaluări
- Istoria TelecomunicatiilorDocument8 paginiIstoria TelecomunicatiilorVictor RotaruÎncă nu există evaluări
- Cele 5 ExtinctiiDocument6 paginiCele 5 ExtinctiiRubio GabzÎncă nu există evaluări
- Lucrare Practica La GeoDocument17 paginiLucrare Practica La GeoMarina TepordeiÎncă nu există evaluări
- Regnul ProtistaDocument101 paginiRegnul ProtistaVera TudoseÎncă nu există evaluări
- India Sub Coroana BritanicaDocument2 paginiIndia Sub Coroana BritanicaCapatina Adrian100% (1)
- Compoziția Corpului Uman CA Elemente Și CompușiDocument10 paginiCompoziția Corpului Uman CA Elemente Și CompușiBocaiAnghelLucicaIoanaÎncă nu există evaluări
- Șalul VerdeDocument4 paginiȘalul VerdeTamara CerbuscaÎncă nu există evaluări
- Proiect Chimie Apa RegalaDocument3 paginiProiect Chimie Apa RegalaRadutu RebejaÎncă nu există evaluări
- LICHENIIDocument11 paginiLICHENIIcristinaÎncă nu există evaluări
- Perioada DevonianaDocument2 paginiPerioada DevonianaDaniela Mc100% (1)
- Chimia in Viata de Zi Cu ZiDocument14 paginiChimia in Viata de Zi Cu ZiDanutz AlexanderÎncă nu există evaluări
- Igiena Sistemului NervosDocument11 paginiIgiena Sistemului NervosСветлана ГригореануÎncă nu există evaluări
- Mamifere 1Document13 paginiMamifere 1Stan LoredanaÎncă nu există evaluări
- Un Port La RăsăritDocument1 paginăUn Port La RăsăritAnyaAna100% (1)
- Chimie Evaluare 29.04Document3 paginiChimie Evaluare 29.04dumitrita4gorbencoÎncă nu există evaluări
- Problemele de Mediu În Raport Cu Aplicarea Nemetalelor Și A Compușilor Lor În Activitatea CotidianăDocument10 paginiProblemele de Mediu În Raport Cu Aplicarea Nemetalelor Și A Compușilor Lor În Activitatea CotidianăDjGeniusEyesÎncă nu există evaluări
- Rolul Biologic Al MagneziuluiDocument10 paginiRolul Biologic Al MagneziuluiMarinela MureaÎncă nu există evaluări
- Reactivi: Ustensile:: Cuso, CusoDocument2 paginiReactivi: Ustensile:: Cuso, CusoOlga RabeiÎncă nu există evaluări
- Apa in Organismul UmanDocument2 paginiApa in Organismul UmanOdetteÎncă nu există evaluări
- Chimia in Viata Cotidiana 1-2Document30 paginiChimia in Viata Cotidiana 1-2Cristiina AlexandruÎncă nu există evaluări
- ParameciulDocument2 paginiParameciulCătălina BardăÎncă nu există evaluări
- Referat ApăDocument7 paginiReferat ApăAddishaÎncă nu există evaluări
- 1.noţiuni Generale Despre CeluleDocument5 pagini1.noţiuni Generale Despre CeluleAndreea100% (1)
- Cerul EseuDocument2 paginiCerul EseuMunteanu Maria-MagdalenaÎncă nu există evaluări
- Referat La Chimie - ApaDocument1 paginăReferat La Chimie - ApaValentin IonutÎncă nu există evaluări