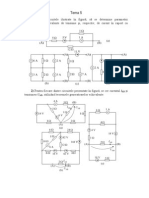
Documente Academic
Documente Profesional
Documente Cultură
Forţa Electromotoare A Pilei Daniell-Jacobi
Încărcat de
AdrianaTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Forţa Electromotoare A Pilei Daniell-Jacobi
Încărcat de
AdrianaDrepturi de autor:
Formate disponibile
4.2.
Forţa electromotoare a pilei Daniell-Jacobi
Scopul lucrării
Se determină dependenţa forţei electromotoare a pilei Daniell-Jacobi în funcţie de
concentraţia soluţiei de electrolit şi se calculează constanta de echilibru pentru procesul
electrochimic din pilă.
Introducere
Pilele electrochimice (sau elemente galvanice) sunt dispozitive în care, în procesele
electrochimice, energia chimică se transformă în energie electrică.
Pilele electrochimice sunt alcătuite din două semielemente unite printr-o punte de sare
sau diafragmă care împiedică amestecarea electroliţilor dar permite trecerea ionilor între cele
două semielemente.
Fiecare semielement este format dintr-un electrod:
- anodul (-) este electrodul cu potenţialul de electrod de reducere mai negativ unde are
loc reacţia de oxidare;
- catodul (+) este electrodul cu potenţialul de reducere mai pozitiv unde are loc reacţia
de reducere.
Pila Daniell-Jacobi este o pilă electrochimică reversibilă, reprezentată prin următorul
lanţ electrochimic:
(-) Zn / ZnSO4 (a1) // CuSO4 (a2) / Cu (+) (4.2.1)
Când circuitul electric este închis la electrozi au loc simultan următoarele reacţii
electrochimice care generează curentul electric:
Anod (-): Zn oxidare Zn2+ + 2e- (4.2.2)
- reducere
Catod (+): Cu2 + + 2e Cu
(4.2.3)
Reacţia globală: Zn + Cu2+ Zn2+ + Cu (4.2.4)
Tensiunea electromotoare E a unei pile electrochimice este diferenţa dintre
potenţialele de electrod ale catodului, ε c şi anodului, ε a:
E=ε + -ε - = ε c- ε a (4.2.5)
Reprezentarea schematică a pilei Daniell-Jacobi este prezentată în figura 4.2.1:
Fig. 4.2.1 Reprezentarea schematica a pilei Daniell-Jacobi
Se observă că anodul de zinc se consumă în timp ce la catod se depune cupru.
Valorile numerice ale potenţialului de electrod sunt date de relaţia lui Nernst:
RT a Zn 2 +
ε Zn 2+
/ Zn
= ε Zn
0
2+
/ Zn
+ ln (4.2.6)
nF a Zn
RT a Cu 2 +
ε Cu 2+
/ Cu
= ε Cu
0
2+
/ Cu
+ ln (4.2.7)
nF a Cu
în care: ε 0
este potenţialul de electrod standard;
R - constanta universală a gazelor ideale;
F- constanta lui Faraday (F = 96487.3 [C/Eg] = 23062.9 [cal/V·Eg]);
n - numărul de electroni transferaţi în reacţia redox;
T - temperatura absolută, [K];
a- activitatea termodinamică (a = f∙c; unde c este concentraţia soluţiei de electrolit, iar
f - coeficientul de activitate).
Pentru soluţii foarte diluate f →1, deci a → c. Pentru metale pure a = 1.
Tensiunea electromotoare a pilei respectă relaţia lui Nernst:
RT aCu 2 +
E = ε Cu 2 + / Cu − ε Zn 2 + / Zn = (ε Cu
0
2+
/ Cu
− ε Zn
0
2+
/ Zn
)+ ln (4.2.8)
2 F a Zn 2 +
Forţa electromotoare standard a pilei este:
E 0 = ε Cu
0
2+
/ Cu
− ε Zn
0
2+
/ Zn (4.2.9)
La temperatura de 298 K relaţia (4.2.8) devine:
0,059 a Cu 2 +
E = E0 + lg (4.2.10)
2 a Zn 2 +
Din relaţia (1.8) rezultă că tensiunea electromotoare a unei pile depinde de
concentraţiile electroliţilor de la cei doi electrozi, de temperatură şi de numărul de electroni
implicaţi în procesul redox.
Lucrul electric produs de un element galvanic la presiune şi la temperatură constantă
este:
W = −∆GT0 = nFE (4.2.11)
şi ∆GT0 = −nFE (4.2.12)
Pentru ∆ G < 0 sau ( E > 0) reacţia electrochimică din pilă are loc spontan, deci
elementul galvanic debitează curent electric.
Constanta de echilibru pentru procesul electrochimic din pila reversibilă se poate
determina pe baza entalpiei libere de reacţie:
∆GT0 = −RT ln K (4.2.13)
nFE
Combinând relaţiile (4.2.11) şi (4.2.12) rezultă: ln K = (4.2.14)
RT
Aparatură şi substanţe: electrod de zinc, electrod de cupru, punte de sare sau bandă de hârtie
de filtru umezită în electrolit, milivoltmetru electronic, soluţii de ZnSO 4 şi CuSO4 de diferite
concentraţii.
Mod de lucru
Se alcătuiesc succesiv următoarele pile:
I: (-) Zn / ZnSO4 (cZnSO4 = 1 M) // CuSO4 (cCuSO4 = 1 M) /Cu(+)
II: (-) Zn / ZnSO4 (cZnSO4 = 0,5M) // CuSO4 (cCuSO4 =1M) /Cu(+)
III: (-) Zn / ZnSO4 (cZnSO4 = 0,1M) // CuSO4 (cCuSO4 = 1M) /Cu(+)
IV: (-) Zn / ZnSO4 (cZnSO4 = 0,05M) // CuSO4 (cCuSO4 = 1M) /Cu(+)
V: (-) Zn / ZnSO4 (cZnSO4 = 0,01M) // CuSO4 (cCuSO4 = 1M) /Cu(+)
Legătura dintre semielemente se face prin puntea de sare sau în absenţa ei cu hârtie de
filtru umezită în soluţia de electrolit.
Se conectează electrozii pilei la bornele milivoltmetrului electronic, respectând polarităţile
şi se măsoară tensiunea electromotoare a pilei.
Rezultate şi calcule
Se notează succesiv valorile tensiunii electromotoare determinate experimental pentru
fiecare din cele 5 elemente galvanice.
Se calculează tensiunile electromotoare cu relaţia (4.2.10) şi se compară cu valorile
determinate experimental.
În calcul se introduc: ε Zn
0
2+
/ Zn
= −0,763[ V ], ε Cu
0
2+
/ Cu
= 0,337 [ V ] şi valorile
coeficienţilor de activitate, f.
Coeficient de activitate
Electrolit
0,001M 0,01M 0,05M 0,1M 0,5M 1M
CuSO4 0,74 0,438 0,217 0,154 0,062 0,043
ZnSO4 0,70 0,387 0,202 0,150 0,063 0,043
Se calculează constanta de echilibru pentru reacţia redox din cele 5 pile electrochimice cu
relaţia (4.2.14) şi se discută valorile obţinute.
Se întocmeşte următorul tabel:
Pila Eexp, Ecalc, ∆ E,
electrochimică [V] [V] [V]
I
II
III
IV
V
Se reprezintă grafic dependenţa E = f (cZn2+) pentru c Cu 2+
/ Cu
= 1[mol / L] şi se
comenteaza.
S-ar putea să vă placă și
- Lab - Forta Electromotoare A Pilei Daniell-3Document2 paginiLab - Forta Electromotoare A Pilei Daniell-3mirela borcauÎncă nu există evaluări
- 9.forţa Electromotoare A Pilei Daniell-JacobiDocument5 pagini9.forţa Electromotoare A Pilei Daniell-JacobiLefter PopescuÎncă nu există evaluări
- L2 - Forţa Electromotoare A Pilei Daniell-JacobiDocument7 paginiL2 - Forţa Electromotoare A Pilei Daniell-JacobiMaria MagdalenaÎncă nu există evaluări
- Forta Electromotoare A Pilei Daniell Var Cu CalculeDocument5 paginiForta Electromotoare A Pilei Daniell Var Cu CalculeAdrianÎncă nu există evaluări
- 9.pile Electrice. Dependenţa Tensiunii Electromotoare de Concentraţia Soluţiilor de Electrolit (Pila Daniell-Jacobi) .Document10 pagini9.pile Electrice. Dependenţa Tensiunii Electromotoare de Concentraţia Soluţiilor de Electrolit (Pila Daniell-Jacobi) .Lefter PopescuÎncă nu există evaluări
- 7.pila Daniell-JacobiDocument4 pagini7.pila Daniell-Jacobijellylorum22Încă nu există evaluări
- Pile Electro ChimiceDocument21 paginiPile Electro ChimiceVictor RusuÎncă nu există evaluări
- Curs 11-Pile Electrice 2021Document36 paginiCurs 11-Pile Electrice 2021Roxana AldeaÎncă nu există evaluări
- Referat Dependenţa Tensiunii Electromotoare (Daniell)Document9 paginiReferat Dependenţa Tensiunii Electromotoare (Daniell)sandahozaÎncă nu există evaluări
- L2 1 Pila Daniell-JacobiDocument5 paginiL2 1 Pila Daniell-JacobimarianchiÎncă nu există evaluări
- Chimie Fizica - ElectrochimieDocument21 paginiChimie Fizica - ElectrochimiematulicaÎncă nu există evaluări
- Foru0163a Electromotoare A Pilei Daniell-JacobiDocument4 paginiForu0163a Electromotoare A Pilei Daniell-JacobiDaniel AnghelÎncă nu există evaluări
- 7-8MAM Pile GalvDocument11 pagini7-8MAM Pile GalvAndrei DianaÎncă nu există evaluări
- Daniell Iacobi+ Pot Standard 2017Document7 paginiDaniell Iacobi+ Pot Standard 2017VictorStefanÎncă nu există evaluări
- Determinarea Potenţialului de CoroziuneDocument4 paginiDeterminarea Potenţialului de CoroziuneAdriana50% (2)
- Daniell Iacobi+ Pot StandardDocument6 paginiDaniell Iacobi+ Pot StandardCristian EnacheÎncă nu există evaluări
- Pile GalvaniceDocument33 paginiPile Galvanicemirceaion650% (1)
- Curs 7Document28 paginiCurs 7Alexandra Popa-NicaÎncă nu există evaluări
- Pile Electrice - Utilizari Tehnologice 2014Document5 paginiPile Electrice - Utilizari Tehnologice 2014mihnea09Încă nu există evaluări
- 5.forta Electromotoare A Pilei DaniellDocument2 pagini5.forta Electromotoare A Pilei DaniellAlexandru StratanÎncă nu există evaluări
- Electro Chim I eDocument224 paginiElectro Chim I eIoana AndreeaÎncă nu există evaluări
- A Pilei DaniellDocument4 paginiA Pilei DaniellAlex VanceaÎncă nu există evaluări
- Influenta Concentratiei Asupra Potentialului de Electrod.Document4 paginiInfluenta Concentratiei Asupra Potentialului de Electrod.Cristina CorneaÎncă nu există evaluări
- ElectrochimieDocument22 paginiElectrochimieSabina Mădălina VieriuÎncă nu există evaluări
- Pile Electrice - Utilizari TehnologiceDocument5 paginiPile Electrice - Utilizari TehnologiceLazar MioaraÎncă nu există evaluări
- Pile Electrice - Utilizari Tehnologice 2014Document5 paginiPile Electrice - Utilizari Tehnologice 2014mihnea09Încă nu există evaluări
- Barbu Roberto Andreas Potential StandardDocument2 paginiBarbu Roberto Andreas Potential StandardRobert BarbuÎncă nu există evaluări
- Forţa Electromotoare A Pilei Daniell-JacobiDocument5 paginiForţa Electromotoare A Pilei Daniell-JacobiMihai BoeruÎncă nu există evaluări
- Procese de Electrod PDFDocument9 paginiProcese de Electrod PDFAndreea DobreÎncă nu există evaluări
- Referat Determinarea Potenţialului Standard de ElectrodDocument5 paginiReferat Determinarea Potenţialului Standard de ElectrodsandahozaÎncă nu există evaluări
- Chimie Laborator 6 - Pile GalvaniceDocument3 paginiChimie Laborator 6 - Pile GalvaniceGeorgiana GhÎncă nu există evaluări
- Conversia ElectrochimicaDocument11 paginiConversia ElectrochimicaAnonymous tKq1m8MUÎncă nu există evaluări
- Daniell Iacobi+ Pot Standard 2015Document7 paginiDaniell Iacobi+ Pot Standard 2015whoiam1110Încă nu există evaluări
- Rafinare CupruluiDocument6 paginiRafinare CupruluiRăzvan GarbeaÎncă nu există evaluări
- Pila Daniell-JacobiDocument4 paginiPila Daniell-JacobiElena-Catalina Stan0% (1)
- Pila Daniel JacobiDocument6 paginiPila Daniel JacobiAlexandru GhiocaÎncă nu există evaluări
- Deter Min Area Potentialului Standard de ElectrodDocument2 paginiDeter Min Area Potentialului Standard de ElectrodluciferaraÎncă nu există evaluări
- Pile ElectriceDocument24 paginiPile ElectriceVlad ȘtefanÎncă nu există evaluări
- Coroziune - Determinarea Potenţialului de Coroziune.Document4 paginiCoroziune - Determinarea Potenţialului de Coroziune.Lefter PopescuÎncă nu există evaluări
- 7.protectia Catodica Cu Anozi de SacrificiuDocument2 pagini7.protectia Catodica Cu Anozi de SacrificiuFlorentin ClaudiuÎncă nu există evaluări
- Sistemul PeriodicDocument25 paginiSistemul PeriodicIrina Tamas100% (1)
- Aplicatii Ale Electrodepunerii PDFDocument31 paginiAplicatii Ale Electrodepunerii PDFCodrin DolhascuÎncă nu există evaluări
- Chimie CL Ix Notiuni Teoretice Si Exemple Reactii RedoxDocument8 paginiChimie CL Ix Notiuni Teoretice Si Exemple Reactii RedoxtudorbasÎncă nu există evaluări
- Curs Tipuri de Pile Electrice - Acumulatori Si Pile de Combustie (Compatibility Mode)Document23 paginiCurs Tipuri de Pile Electrice - Acumulatori Si Pile de Combustie (Compatibility Mode)Adrian Vlada80% (5)
- Electrochimie Si Coroziune - Electrozi de Ordinul IDocument43 paginiElectrochimie Si Coroziune - Electrozi de Ordinul IBurjilabogy Burjila100% (1)
- Probleme Pile ElectriceDocument2 paginiProbleme Pile ElectriceRoxana AldeaÎncă nu există evaluări
- Lab CuprareaDocument3 paginiLab Cuprareamirela borcauÎncă nu există evaluări
- 7electrochimie Test 7Document4 pagini7electrochimie Test 7Adrian-Laurențiu CăileanÎncă nu există evaluări
- Curs6 ProgramareDinamicaDocument7 paginiCurs6 ProgramareDinamicaAdrianaÎncă nu există evaluări
- Instituțiile BancareDocument16 paginiInstituțiile BancareAdrianaÎncă nu există evaluări
- Curs 2 - Stive Si CoziDocument4 paginiCurs 2 - Stive Si CoziAdrianaÎncă nu există evaluări
- Curs 6 - Divide Et ImperaDocument3 paginiCurs 6 - Divide Et ImperaAdrianaÎncă nu există evaluări
- Curs7 SortareDocument4 paginiCurs7 SortareAdrianaÎncă nu există evaluări
- Curs 6 - GreedyDocument2 paginiCurs 6 - GreedyAdrianaÎncă nu există evaluări
- Curs6 GreedyDocument2 paginiCurs6 GreedyAdrianaÎncă nu există evaluări
- Curs6 BBDocument28 paginiCurs6 BBAdrianaÎncă nu există evaluări
- Curs6 GreedyDocument6 paginiCurs6 GreedyAdrianaÎncă nu există evaluări
- Curs6 BacktrackingDocument11 paginiCurs6 BacktrackingAdrianaÎncă nu există evaluări
- 1 2 3 4 5 6 Min Pe Linii 1 2 3 4 5 6 Graf Original - ADocument27 pagini1 2 3 4 5 6 Min Pe Linii 1 2 3 4 5 6 Graf Original - AAdrianaÎncă nu există evaluări
- TemaSeminar13 Bazele ElectrotehniciiDocument1 paginăTemaSeminar13 Bazele ElectrotehniciiAdrianaÎncă nu există evaluări
- Curs6 DivideEtImperaDocument9 paginiCurs6 DivideEtImperaAdrianaÎncă nu există evaluări
- Divide Et ImperaDocument3 paginiDivide Et ImperaCypeanÎncă nu există evaluări
- Curs 1Document12 paginiCurs 1AdrianaÎncă nu există evaluări
- Curs4 ArboriBinari CompletareDocument14 paginiCurs4 ArboriBinari CompletareAdrianaÎncă nu există evaluări
- Curs5 GrafuriDocument15 paginiCurs5 GrafuriAdrianaÎncă nu există evaluări
- Liste SecventialeDocument2 paginiListe SecventialeAdrianaÎncă nu există evaluări
- Stive Si CoziDocument4 paginiStive Si CoziAdrianaÎncă nu există evaluări
- Curs 3Document3 paginiCurs 3AdrianaÎncă nu există evaluări
- Examene Partiale 2010 Sem2Document1 paginăExamene Partiale 2010 Sem2AdrianaÎncă nu există evaluări
- Calendar Semestrul II 2010 2011Document4 paginiCalendar Semestrul II 2010 2011AdrianaÎncă nu există evaluări
- ORAR An1 2010-2011 s2 v5Document9 paginiORAR An1 2010-2011 s2 v5AdrianaÎncă nu există evaluări
- Curs4 ArboriBinariDocument16 paginiCurs4 ArboriBinariAdrianaÎncă nu există evaluări
- Curs 2Document12 paginiCurs 2AdrianaÎncă nu există evaluări
- TemaSeminar6 Bazele ElectrotehniciiDocument1 paginăTemaSeminar6 Bazele ElectrotehniciiAdrianaÎncă nu există evaluări
- TemaSeminar12 Bazele ElectrotehniciiDocument1 paginăTemaSeminar12 Bazele ElectrotehniciiAdrianaÎncă nu există evaluări
- TemaSeminar2 Bazele ElectrotehniciiDocument2 paginiTemaSeminar2 Bazele ElectrotehniciiAdrianaÎncă nu există evaluări
- TemaSeminar5 Bazele ElectrotehniciiDocument2 paginiTemaSeminar5 Bazele ElectrotehniciiAdrianaÎncă nu există evaluări
- TemaSeminar3 Bazele ElectrotehniciiDocument1 paginăTemaSeminar3 Bazele ElectrotehniciiAdrianaÎncă nu există evaluări