Documente Academic
Documente Profesional
Documente Cultură
Utilizările SODIULUI
Încărcat de
Felicia Alina RosiaDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Utilizările SODIULUI
Încărcat de
Felicia Alina RosiaDrepturi de autor:
Formate disponibile
UTILIZĂRILE SODIULUI
Sodiul (sau Natriul) este un element chimic cu simbolul Na și numărul atomic 11. Este
un metal alcalin, argintiu și moale. În stare liberă, reacționează violent cu apa și ia foc în aer la
temperaturi de peste 115 ͦ C. La temperatură obișnuită, lăsat în aer, fumegă. Sodiul se obține prin
electoliza uscată a clorurii de sodiu (NaCl) sau a hidroxidului de sodiu (NaOH), în stare topită.
ELECTROLIZĂ=descompunere cu ajutorul electricității.
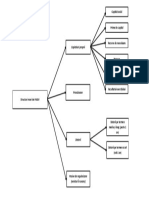
Dintre utilizările sodiului, cele mai importante sunt:
În aliaje, pentru a le îmbunătăți proprietățile;
În săpunuri, în combinație cu acizii grași, formând cu aceștia săruri slabe, ușor dizolvabile,
având caracter degresant;
În lămpi cu vapori de sodiu care sunt cele mai eficiente surse de lumină albă;
Pentru purificarea metalelor topite;
Încălzit în aer, sodiul se aprinde și arde cu flacără galbenă rezultând peroxid de sodiu (Na2O2)
și oxid de sodiu (Na2O);
Pentru industrie, compușii cei mai importanți sunt: clorura de sodiu (NaCl), carbonatul de sodiu
(Na2CO3) și bicarbonatul de sodiu (NaHCO3). De asemenea, sodiul are o bună conductivitate
termică, motiv pentru care se folosește la capetele supapelor de la motoarele de avion cu scopul
de a elimina mai repede căldura formată. Un aliaj de sodiu și potasiu se utilizează ca lichid de
răcire în unele tipuri de reactori nucleari.
Sodiul arde cu o culoare galben strălucitor și, de asemenea, este utilizat în focurile de
artificii pentru a face o culoare galben intens.
Cel mai important compus al sodiului este clorura de sodiu (NaCl), numită și sare gemă
(sare de bucătărie), care este indispensabilă vieții oamenilor și animalelor.
Realizat de Roșia Sebastian, clasa a IX-a A.
S-ar putea să vă placă și
- Model Cerere Revenire Din Concediu Crestere CopilDocument1 paginăModel Cerere Revenire Din Concediu Crestere CopilFelicia Alina Rosia50% (2)
- Vasile Voiculescu Ultimul BerevoiDocument9 paginiVasile Voiculescu Ultimul BerevoiJabbari Paydar Gholam Reza100% (1)
- SodiulDocument3 paginiSodiulFlorian Lucian60% (5)
- Importanta NaClDocument5 paginiImportanta NaClTudor Chereches80% (5)
- Clorura de SodiuDocument11 paginiClorura de SodiuBogdan Hapeci80% (20)
- Curiozitati FizicaDocument6 paginiCuriozitati FizicaTibi Cosereanu100% (2)
- AcetilenaDocument4 paginiAcetilenaYuukikoÎncă nu există evaluări
- Referat Chimie-PetrolulDocument2 paginiReferat Chimie-PetrolulBistea Iuliana Elena67% (3)
- Rolul FotosintezeiDocument4 paginiRolul FotosintezeiSabina Nistor100% (2)
- Repausul Dominical I L CaragialeDocument6 paginiRepausul Dominical I L CaragialeAndreea MocanuÎncă nu există evaluări
- SodiuDocument2 paginiSodiuAndreea David0% (1)
- Sodiu, Clor, Clorura de SodiuDocument18 paginiSodiu, Clor, Clorura de Sodiumititica_laura100% (1)
- Clorura de SodiuDocument2 paginiClorura de SodiuAlexandra Maria60% (5)
- Apa Ca Solvent PDFDocument7 paginiApa Ca Solvent PDFme_bruxinha9231100% (1)
- SODIUDocument2 paginiSODIUIonica PorumbÎncă nu există evaluări
- Referat ClorDocument3 paginiReferat ClorNidelea Rareș100% (2)
- ClorulDocument14 paginiClorulOana Lavinia Achim100% (1)
- (Na) Sodiu ReferatDocument3 pagini(Na) Sodiu ReferatCalin Gruia100% (7)
- (NaCl) - Clorua de Sodiu-ReferatDocument3 pagini(NaCl) - Clorua de Sodiu-ReferatCalin Gruia50% (8)
- CristalohidratiDocument5 paginiCristalohidratiScott Wilson100% (2)
- SOLUTIIDocument12 paginiSOLUTIIAlexa NicolÎncă nu există evaluări
- Coroziune Metalelor REFERAT CHIMIEDocument5 paginiCoroziune Metalelor REFERAT CHIMIEAlex Damashkan100% (3)
- Sodiu ReferatDocument2 paginiSodiu ReferatAlexandruyeah100% (1)
- Proprietatile Si Utilizarile ACIDULUI SULFURICDocument8 paginiProprietatile Si Utilizarile ACIDULUI SULFURICGligan Diana100% (1)
- Importanța Și Utilizarea AcizilorDocument2 paginiImportanța Și Utilizarea AcizilorAlina CojocaruÎncă nu există evaluări
- Proprietatile Chimice Ale CloruluiDocument3 paginiProprietatile Chimice Ale CloruluiTammy Gheorghe75% (4)
- Reactia de Neutralizare in Viata de Zi CuDocument19 paginiReactia de Neutralizare in Viata de Zi CuMaria IstrateÎncă nu există evaluări
- Reactia de Descompunere-Importanta PracticaDocument6 paginiReactia de Descompunere-Importanta PracticaMM33% (6)
- Comparatie Mitoza-MeiozaDocument18 paginiComparatie Mitoza-MeiozaMaria FilipÎncă nu există evaluări
- Utilizarile Acidului Clorhidric - ChimieDocument1 paginăUtilizarile Acidului Clorhidric - ChimieMitrea Andreea100% (2)
- Interactii IntermoleculareDocument3 paginiInteractii IntermoleculareAlina ComanÎncă nu există evaluări
- Cristalul de NaClDocument3 paginiCristalul de NaClAndrei Vanghele50% (4)
- CristalohidratiDocument6 paginiCristalohidratiYoon Dahwi100% (2)
- Ultimul Berevoi Caraterizarea VrajitoruluiDocument1 paginăUltimul Berevoi Caraterizarea VrajitoruluiSABINA BUDACĂÎncă nu există evaluări
- P V DeteriorareDocument2 paginiP V DeteriorareFelicia Alina RosiaÎncă nu există evaluări
- Utilizarile CloruluiDocument1 paginăUtilizarile CloruluiLiliana Ciorbă100% (4)
- SodiuDocument9 paginiSodiuMaria Raducanu0% (1)
- ,,clorură de Sodiu-Materie Primă În Industria Chimică"Document8 pagini,,clorură de Sodiu-Materie Primă În Industria Chimică"Sanda TeodorÎncă nu există evaluări
- 3 Utilizarile OxizilorDocument14 pagini3 Utilizarile OxizilorMarianaCiocîrlan75% (4)
- Hidroxid de SodiuDocument4 paginiHidroxid de SodiuIoana Catalina100% (1)
- Ciuperci Otravitoare Și ComestibileDocument23 paginiCiuperci Otravitoare Și ComestibileFelicia TudorÎncă nu există evaluări
- Carbunii de PamantDocument6 paginiCarbunii de PamantCarmÎncă nu există evaluări
- Metale Și Nemetale - Proprietăți Fizice GeneraleDocument13 paginiMetale Și Nemetale - Proprietăți Fizice GeneraleMihaela Saviuc100% (1)
- Importanta in Lumea Vie A Sodiului Calciului Si A MagneziuluiDocument1 paginăImportanta in Lumea Vie A Sodiului Calciului Si A MagneziuluiConstantinescu AnamariaÎncă nu există evaluări
- Referat Chimie AciziiDocument3 paginiReferat Chimie AciziiDavid BucurÎncă nu există evaluări
- Clor Stare NaturalaDocument2 paginiClor Stare Naturalanuzzo50% (2)
- ZaharozaDocument10 paginiZaharozaAndon Alin100% (1)
- Petrolul ProiectDocument13 paginiPetrolul ProiectDita DumitruÎncă nu există evaluări
- Clorura de SodiuDocument5 paginiClorura de SodiuCristina Enea0% (1)
- Starea Lichida Si SolidaDocument5 paginiStarea Lichida Si SolidaAndreea Ghetze100% (1)
- Utilizarea Apei CA Solvent inDocument4 paginiUtilizarea Apei CA Solvent inRoxana Andreea Tătaru0% (1)
- CHIMIEDocument4 paginiCHIMIEAna Maria55% (11)
- Importanta in Lumea Vie A Trei Elemente Cu Caracter MetalicDocument8 paginiImportanta in Lumea Vie A Trei Elemente Cu Caracter MetalicpredescuÎncă nu există evaluări
- Ciulinii Baraganului - RezumatDocument2 paginiCiulinii Baraganului - RezumatRoxana BaltaretuÎncă nu există evaluări
- La MoșiDocument3 paginiLa MoșiAnda AndaÎncă nu există evaluări
- Referat Omul Este Responsabil de Faptele SaleDocument7 paginiReferat Omul Este Responsabil de Faptele SaleMonika Kovacs100% (3)
- Cronica HarryDocument3 paginiCronica HarryNastase Mihaela75% (4)
- Scene Din Viata de Ieri Si de AziDocument1 paginăScene Din Viata de Ieri Si de AziBogdan Nitu89% (9)
- Motive Și Simboluri În Nuvela FantasticăDocument2 paginiMotive Și Simboluri În Nuvela FantasticăGeorgiana Elena Alexe0% (1)
- Despre CL EseuDocument6 paginiDespre CL Eseualex_document67% (3)
- Sodiul Si Compusii LuiDocument3 paginiSodiul Si Compusii LuisimsimoniÎncă nu există evaluări
- Prezentare SodiuDocument8 paginiPrezentare SodiuAndreea CarmenÎncă nu există evaluări
- 13a. Enigma Otiliei - Tema Si ViziuneDocument2 pagini13a. Enigma Otiliei - Tema Si ViziuneFelicia Alina RosiaÎncă nu există evaluări
- Anaf 3Document3 paginiAnaf 3Toderas NicoletaÎncă nu există evaluări
- Cerere Suspendare Contract CIC 1Document1 paginăCerere Suspendare Contract CIC 1Felicia Alina RosiaÎncă nu există evaluări
- PlumbDocument4 paginiPlumbFelicia Alina RosiaÎncă nu există evaluări
- InstructiuniDepunereA4200 20180926Document9 paginiInstructiuniDepunereA4200 20180926m1tza88Încă nu există evaluări
- Continutul Dosarului de Somaj Recuperare CciDocument1 paginăContinutul Dosarului de Somaj Recuperare CciFelicia Alina RosiaÎncă nu există evaluări
- Def Dividende+exDocument4 paginiDef Dividende+exFelicia Alina RosiaÎncă nu există evaluări
- Acatistul Maicii Domnului Grabnic AjutatoareDocument9 paginiAcatistul Maicii Domnului Grabnic AjutatoaredndimaÎncă nu există evaluări
- Acord Prelucrare Date SalariatDocument1 paginăAcord Prelucrare Date SalariatFelicia Alina RosiaÎncă nu există evaluări
- ColideDocument12 paginiColideFelicia Alina RosiaÎncă nu există evaluări
- InstructiuniDepunereA4200 20180926Document9 paginiInstructiuniDepunereA4200 20180926m1tza88Încă nu există evaluări
- Revisal 2018Document7 paginiRevisal 2018Felicia Alina RosiaÎncă nu există evaluări
- ACTIVDocument1 paginăACTIVFelicia Alina RosiaÎncă nu există evaluări
- Referat SomajDocument1 paginăReferat SomajFelicia Alina RosiaÎncă nu există evaluări
- Facturarea 2018Document6 paginiFacturarea 2018Felicia Alina RosiaÎncă nu există evaluări
- PoezieDocument1 paginăPoezieFelicia Alina RosiaÎncă nu există evaluări
- Lecții m2Document6 paginiLecții m2Felicia Alina RosiaÎncă nu există evaluări
- OrarDocument1 paginăOrarFelicia Alina RosiaÎncă nu există evaluări
- PASIVDocument1 paginăPASIVFelicia Alina RosiaÎncă nu există evaluări
- PoezieDocument1 paginăPoezieFelicia Alina RosiaÎncă nu există evaluări
- Portofoliu, 10Document1 paginăPortofoliu, 10Felicia Alina RosiaÎncă nu există evaluări
- LaptopDocument2 paginiLaptopFelicia Alina RosiaÎncă nu există evaluări
- OrarDocument1 paginăOrarFelicia Alina RosiaÎncă nu există evaluări
- PostulDocument1 paginăPostulFelicia Alina RosiaÎncă nu există evaluări
- CrăciunulDocument1 paginăCrăciunulFelicia Alina RosiaÎncă nu există evaluări
- English ArticleDocument2 paginiEnglish ArticleFelicia Alina RosiaÎncă nu există evaluări
- Utilizările SODIULUIDocument1 paginăUtilizările SODIULUIFelicia Alina RosiaÎncă nu există evaluări
- ISTORIEDocument1 paginăISTORIEFelicia Alina RosiaÎncă nu există evaluări