0% au considerat acest document util (0 voturi)
88 vizualizări4 paginiCurba de Echilibru Lichid-Vapori Şi Entalpia de Vaporizare: 1. Scopul Lucrării
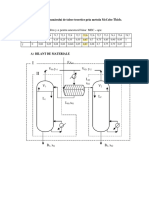
Documentul prezintă metoda Ramsay-Young pentru determinarea curbei de echilibru lichid-vapori şi a entalpiei de vaporizare pentru apă. Se descrie aparatura folosită, modul de lucru experimental şi prelucrarea datelor pentru a calcula entalpia de vaporizare a apei şi a o compara cu valoarea din literatură.
Încărcat de
matacandreeaDrepturi de autor
© © All Rights Reserved
Respectăm cu strictețe drepturile privind conținutul. Dacă suspectați că acesta este conținutul dumneavoastră, reclamați-l aici.
Formate disponibile
Descărcați ca PDF, TXT sau citiți online pe Scribd
0% au considerat acest document util (0 voturi)
88 vizualizări4 paginiCurba de Echilibru Lichid-Vapori Şi Entalpia de Vaporizare: 1. Scopul Lucrării
Documentul prezintă metoda Ramsay-Young pentru determinarea curbei de echilibru lichid-vapori şi a entalpiei de vaporizare pentru apă. Se descrie aparatura folosită, modul de lucru experimental şi prelucrarea datelor pentru a calcula entalpia de vaporizare a apei şi a o compara cu valoarea din literatură.
Încărcat de
matacandreeaDrepturi de autor
© © All Rights Reserved
Respectăm cu strictețe drepturile privind conținutul. Dacă suspectați că acesta este conținutul dumneavoastră, reclamați-l aici.
Formate disponibile
Descărcați ca PDF, TXT sau citiți online pe Scribd