Documente Academic
Documente Profesional
Documente Cultură
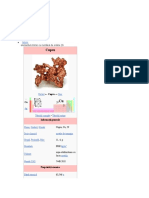
Rubidiu
Încărcat de
Craita BusuiocDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Rubidiu
Încărcat de
Craita BusuiocDrepturi de autor:
Formate disponibile
Rubidiu
De la Wikipedia, enciclopedia liberă
Rubidiul este un element chimic notat cu simbolul Rb
și care are numărul atomic 37. Rubidiul este un metal Rubidiu
alcalin moale, de culoare alb-argintie; în stare
elementară este foarte reactiv, cu proprietăți similare
altor metale alcaline, precum oxidarea rapidă în aer.
Rubidiul natural este un amestec izotopic: 85Rb,
singurul izotop stabil, cu o concentrație de 72%. Restul
procentelor, de 28% reprezintă izotopul radioactiv 87Rb
ce are timpul de înjumătățire de 49 miliarde de ani - mai
mult de 3 ori vârsta estimată a Universului.
Kripton ← Rubidiu → Stronțiu
Chimiștii germani Robert Bunsen și Gustav Kirchhoff K Rb
37
descoperă rubidiul in 1861 datorită metodei Rb
spectroscopiei atomice.[1] Cs
Compușii rubidiului au diverse aplicații chimice și Tabelul complet • Tabelul extins
electronice. Rubidiul metalic este vaporizat ușor, având Informații generale
un spectru de absorbție bun și fiind utilizat în Nume, Simbol, Număr Rubidiu, Rb, 37
manipularea atomilor prin laser. Serie chimică Metal alcalin
Grupă, Perioadă, Bloc 1, 5, s
Acest metal nu este cunoscut ca având o funcție vitală Densitate 1,532 kg/m³
pentru organisemele vii. Cu toate acestea, a fost Culoare alb, argintiu
Număr CAS 7440-17-7
observat faptul că rubidiul ionic este asimilat de
Proprietăți atomice
organisme similar ionului de potasiu, fiind asimilat activ
Masă atomică 85,4678 u
de către celulele vegetale și animale datorită încărcăturii
Rază atomică 248 pm
similare. Rază de covalență 220±9
Rază van der Waals 303 pm
Configurație electronică [Kr] 5s1
Cuprins Electroni pe nivelul de
energie
2, 8, 18, 8, 1
Istoric Număr de oxidare +1, −1
Oxid bazic
Structură atomică Structură cristalină cubică
Izotopi Proprietăți fizice
Proprietăți Fază ordinară solid
Proprietăți fizice Punct de topire 39.31 °C (102.76
°F), 312.46 K
Proprietăți chimice 688 °C (1270 °F),
Punct de fierbere
961 K
Compușii elementului
Informații diverse
Compuși organici
Unitățile SI și condiții de temperatură și presiune
Răspândire normale dacă nu s-a specificat altfel.
Producere Modifică text (https://ro.wikipedia.org/w/index.php?title
=Rubidiu&action=edit§ion=0)
Preparare în laborator
Producere la scară industrială
Utilizare
Medicină
Alte aplicații
Rolul elementului în biologie
Măsuri de protecție chimică
Toxicitate
Note
Bibliografie
Vezi și
Legături externe
Istoric
Rubidiul a fost descoperit îm 1861 de către chimiștii germani Robert Bunsen și Gustav Kirchhoff.
Numele provine din latinul rubidus.[2]
Structură atomică
Izotopi
Proprietăți
Proprietăți fizice
Proprietăți chimice
În oxigen rubidiul arde formînd superperoxid:
4Rb + O2 = 2Rb2O
La temperaturi obișnuite sau la o mică încălzire rubidiul reacționează cu azotul, siliciul, sulful, halogenii
și alte nemetale:
6Rb + N2 = 2Rb3N
2Rb + H2 = 2RbH
2Rb + Cl2 = 2RbCl (se autoinflamează)
Rubidiul reacționează intens cu acizii minerali:
2Rb + 2HBr = 2RbBr + H2
Intens reacționează cu apa. Hidrogenul, care se degajă se autoinflamează:
2Rb + 2H2O = 2RbOH + H2
Rubidiul se dizolvă în amoniac lichid:
2Rb + NH3 = Rb2NH + H2
Oxidul de rubidiu este un oxid bazic. El poate fi primit pe cale indirectă:
RbO2 + 3Rb = 2Rb2O
El reacționează intens cu acizii, oxizii acizi și amfoteri:
Rb2O + H2O = 2RbOH
Rb2O + H2SO4 = Rb2SO4 + H2O
Hidroxidul de rubidiu este o bază puternică, bine solubilă în apă. El reacționează cu oxizii acizi și
amfoteri, acizii, sărurile metalelor grele și de amoniu, cu unele nemetale și a.
6RbOH + 3Br2 = 5RbBr + RbBrO3 + 3H2O (RbOH fierbinte)
2RbOH + CO2 = Rb2CO3 + H2O
3RbOH + Cr(OH)3= Rb3[Cr(OH)6]
2RbOH + ZnO = Rb2ZnO2 + H2O (la topire)
2RbOH + (NH4)2CO3 = Rb2CO3 + 2NH3 + 2H2O
3RbOH + FeCl3 = Fe(OH)3 + 3RbCl
Sărurile de rubidiu sunt substanțe stabile, ionice, bine solubile în apă. În soluțiile apoase ele disociază
complet. Ionul de rubidiu nu hidrolizează. Cu toate acestea, unii compuși ai rubidiului totuși hidrolizează
în apă. Acestea sînt sărurile acizilor slabi, hidrura de rubidiu, superperoxidul de rubidiu, nitrura, fosfura
și a.:
RbH + H2O = RbOH + H2
Rb3N + 3H2O = 3RbOH + NH3
2RbO2 + 2H2O = 2RbOH + H2O2 + O2
Ionul de rubidiu nu formează anioni complecși.
Compușii elementului
Compuși organici
Răspândire
Producere
Preparare în laborator
Producere la scară industrială
Utilizare
Medicină
Alte aplicații
Rolul elementului în biologie
Măsuri de protecție chimică
Toxicitate
Note
1. ^ Kirchhoff, G.; Bunsen, R. (1861). „Chemische Analyse durch Spectralbeobachtungen”.
Annalen der Physik und Chemie. 189 (7): 337–381. Bibcode:1861AnP...189..337K (http://ad
sabs.harvard.edu/abs/1861AnP...189..337K). doi:10.1002/andp.18611890702 (https://doi.or
g/10.1002%2Fandp.18611890702).
2. ^ Weeks, Mary Elvira (1932). „The discovery of the elements. XIII. Some spectroscopic
discoveries”. Journal of Chemical Education. 9 (8): 1413–1434.
Bibcode:1932JChEd...9.1413W (http://adsabs.harvard.edu/abs/1932JChEd...9.1413W).
doi:10.1021/ed009p1413 (https://doi.org/10.1021%2Fed009p1413).
Bibliografie
Constantin D. Albu, Maria Brezeanu, Mică enciclopedie de chimie, Editura Enciclopedică
Română, 1974, p 423
Vezi și
Tabelul periodic al elementelor
Legături externe
ro Rubidiul pe sistemul-periodic.go.ro (http://www.sistemul-periodic.go.ro/elemente/rb.htm)
Adus de la https://ro.wikipedia.org/w/index.php?title=Rubidiu&oldid=12375522
Ultima editare a paginii a fost efectuată la 11 septembrie 2018, ora 13:15.
Acest text este disponibil sub licența Creative Commons cu atribuire și distribuire în condiții identice; pot exista și
clauze suplimentare. Vedeți detalii la Termenii de utilizare.
S-ar putea să vă placă și
- 4 RubidiuDocument7 pagini4 RubidiuDaniela CristescuÎncă nu există evaluări
- 5 CesiuDocument22 pagini5 CesiuDaniela CristescuÎncă nu există evaluări
- Proiect SodiuDocument5 paginiProiect Sodiualex7.soareÎncă nu există evaluări
- 6 FranciuDocument12 pagini6 FranciuDaniela CristescuÎncă nu există evaluări
- PotasiuDocument22 paginiPotasiuCraita Busuioc100% (1)
- Agentul de Racire Al Reactorului ALFREDDocument19 paginiAgentul de Racire Al Reactorului ALFREDandreidiana1978Încă nu există evaluări
- CesiuDocument18 paginiCesiuCraita BusuiocÎncă nu există evaluări
- Hidrurile Metalelor RareDocument37 paginiHidrurile Metalelor RareSilvia BijuteriiHandmadeÎncă nu există evaluări
- Metale AlcalineDocument13 paginiMetale AlcalineIuliu Pîslaru100% (4)
- Chimie Top 10 Subs.Document12 paginiChimie Top 10 Subs.Дима БоссÎncă nu există evaluări
- 2.legea PeriodicitățiiDocument13 pagini2.legea Periodicității77VladikÎncă nu există evaluări
- CarbonDocument25 paginiCarbonCraita Busuioc0% (1)
- RubidiuDocument9 paginiRubidiuvlmihaiÎncă nu există evaluări
- NEMETALEleDocument6 paginiNEMETALEleAlexandra HarcomiețÎncă nu există evaluări
- CarbonDocument6 paginiCarbonDana NicolaÎncă nu există evaluări
- Chimie Anorganica I-Curs1Document53 paginiChimie Anorganica I-Curs1Ioana Maria MartacÎncă nu există evaluări
- Echipa 2 - Caracter Acid, Caracter BazicDocument17 paginiEchipa 2 - Caracter Acid, Caracter BazicLisaIsaÎncă nu există evaluări
- Acidul AceticDocument12 paginiAcidul AceticAdam Blair50% (4)
- Baze FinalDocument10 paginiBaze FinalCornelia DingaÎncă nu există evaluări
- HidroxiziDocument10 paginiHidroxizidana zbrancaÎncă nu există evaluări
- Carte de IdentitateDocument4 paginiCarte de IdentitateEvelina SopivnicÎncă nu există evaluări
- Proiect Școlar: La Unitatea de Învățare "Metalele" Sodiul - Structura, Proprietățile, UtilizareaDocument11 paginiProiect Școlar: La Unitatea de Învățare "Metalele" Sodiul - Structura, Proprietățile, Utilizareaion boncaÎncă nu există evaluări
- Cursul NR 3-4Document38 paginiCursul NR 3-4Ionut Zoltan100% (1)
- CupruDocument5 paginiCupruAdriana GîrleaÎncă nu există evaluări
- CH - Anorg Ex Scris Ipa 2014-2015Document5 paginiCH - Anorg Ex Scris Ipa 2014-2015CorinaDumitruÎncă nu există evaluări
- CarbonulDocument13 paginiCarbonulCarmen GheorgheÎncă nu există evaluări
- BAZELEDocument4 paginiBAZELEVera SabouÎncă nu există evaluări
- Caracterizarea Generala A AzotuluiDocument4 paginiCaracterizarea Generala A AzotuluidimonskiyCS100% (1)
- Substanțe Anorganice Din Viata MeaDocument8 paginiSubstanțe Anorganice Din Viata MeaConstantin PîslaruÎncă nu există evaluări
- Carbon: Istoric Structură Atomică Proprietăţi Fizice Proprietăţi Chimice Izotopi Compuși În NaturăDocument1 paginăCarbon: Istoric Structură Atomică Proprietăţi Fizice Proprietăţi Chimice Izotopi Compuși În NaturăNenita MihaiÎncă nu există evaluări
- LitiuDocument12 paginiLitiuFilip Maria100% (1)
- Icfes Chemistry Răspunsuri RezolvateDocument24 paginiIcfes Chemistry Răspunsuri RezolvateScribdTranslationsÎncă nu există evaluări
- Chimie AnorganicaDocument18 paginiChimie AnorganicaRuxandra Maria100% (1)
- Substante Anorganice Din Viata Mea - ProiectDocument6 paginiSubstante Anorganice Din Viata Mea - ProiectFeodora FrunzaÎncă nu există evaluări
- Chimie AnorganicaDocument18 paginiChimie AnorganicadancercelÎncă nu există evaluări
- Cursul 4 - Reactii ChimiceDocument5 paginiCursul 4 - Reactii ChimiceGeorgiana Ene ConstantinÎncă nu există evaluări
- NeonDocument7 paginiNeonvioricaÎncă nu există evaluări
- EVALUARE Finală Clasa A 9 ADocument5 paginiEVALUARE Finală Clasa A 9 ALiliana Vizitiu CoșlețÎncă nu există evaluări
- C11-Metale de Tip SDocument15 paginiC11-Metale de Tip Sdia_didu_14Încă nu există evaluări
- 2 SodiuDocument8 pagini2 SodiuDaniela CristescuÎncă nu există evaluări
- 2.3.CL 9 ECUAȚII MOLECULARĂ iONICĂ COMPLETĂ REDUSĂDocument28 pagini2.3.CL 9 ECUAȚII MOLECULARĂ iONICĂ COMPLETĂ REDUSĂAnisoara CiubotaruÎncă nu există evaluări
- Introducere ChimieDocument27 paginiIntroducere ChimieDumy DumiterrÎncă nu există evaluări
- LitiuDocument39 paginiLitiunadeaÎncă nu există evaluări
- Structuri Cristaline Retele 2Document19 paginiStructuri Cristaline Retele 2Manea GabrielÎncă nu există evaluări
- MetaleDocument30 paginiMetaleAndreea Camelia RusnaciucÎncă nu există evaluări
- CarbonulDocument18 paginiCarbonulMelissa OpreaÎncă nu există evaluări
- Chimia AnorganicaDocument46 paginiChimia AnorganicaCristina Popovschi100% (3)
- Perezentare Grupa 16Document51 paginiPerezentare Grupa 16Nicolae Dan100% (1)
- Sarcina:: Caracterizaţi Elementul Chimic Oxigen Conform AlgoritmuluiDocument19 paginiSarcina:: Caracterizaţi Elementul Chimic Oxigen Conform AlgoritmuluiTatiana LunguÎncă nu există evaluări
- Metale AlcalineDocument2 paginiMetale AlcalineTudor CîrlanÎncă nu există evaluări
- Pașaportul Chimic Al Substanței"Document3 paginiPașaportul Chimic Al Substanței"Andrei AvdeevÎncă nu există evaluări
- Caracterizarea Generalã A NemetalelorDocument2 paginiCaracterizarea Generalã A NemetalelorVadim Ciubotaru0% (1)
- Metale Alcaline (Proiect Chimie)Document2 paginiMetale Alcaline (Proiect Chimie)Andrei AvdeevÎncă nu există evaluări
- HidrogenDocument4 paginiHidrogenc1962Încă nu există evaluări
- OXIZI ChimieeDocument18 paginiOXIZI ChimieeChirila SabinaÎncă nu există evaluări
- Curs Metode ElectrochimiceDocument38 paginiCurs Metode ElectrochimiceTachita Viorel100% (1)
- Oxizi FinalDocument10 paginiOxizi FinalCornelia DingaÎncă nu există evaluări
- Casta KșatriyaDocument1 paginăCasta KșatriyaCraita BusuiocÎncă nu există evaluări
- Republica VenețianăDocument2 paginiRepublica VenețianăCraita BusuiocÎncă nu există evaluări
- Sistem ParlamentarDocument1 paginăSistem ParlamentarCraita BusuiocÎncă nu există evaluări
- Războiul Din 1688-1697Document1 paginăRăzboiul Din 1688-1697Craita BusuiocÎncă nu există evaluări
- CnossosDocument3 paginiCnossosCraita BusuiocÎncă nu există evaluări
- George Al II-lea Al Marii BritaniiDocument3 paginiGeorge Al II-lea Al Marii BritaniiCraita BusuiocÎncă nu există evaluări
- Liga de La AugsburgDocument1 paginăLiga de La AugsburgCraita BusuiocÎncă nu există evaluări
- OborDocument3 paginiOborCraita BusuiocÎncă nu există evaluări
- Paul MenuDocument2 paginiPaul MenuCraita BusuiocÎncă nu există evaluări
- Alex Mihai StoenescuDocument6 paginiAlex Mihai StoenescuCraita BusuiocÎncă nu există evaluări
- L'Indépendance RoumaineDocument3 paginiL'Indépendance RoumaineCraita BusuiocÎncă nu există evaluări
- Mănăstirea SteleaDocument2 paginiMănăstirea SteleaCraita BusuiocÎncă nu există evaluări
- CremșnitDocument2 paginiCremșnitCraita BusuiocÎncă nu există evaluări
- DantonDocument2 paginiDantonCraita BusuiocÎncă nu există evaluări
- Maximilien de RobespierreDocument2 paginiMaximilien de RobespierreCraita BusuiocÎncă nu există evaluări
- Georges Jacques DantonDocument2 paginiGeorges Jacques DantonCraita BusuiocÎncă nu există evaluări