0% au considerat acest document util (0 voturi)
303 vizualizări11 paginiProiect Fizica
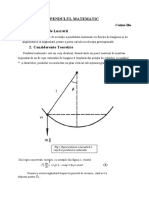
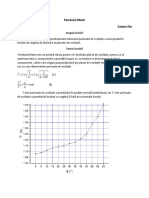
Documentul prezintă definiții și exemple pentru cele trei stări de agregare: solidă, lichidă și gazoasă. De asemenea, explică transformările dintre stările de agregare, precum topirea-solidificarea, vaporizarea-condensarea, evaporarea, lichefierea, sublimarea-desublimarea. Sunt prezentate și concepte ca punctul triplu al apei și punctele critice.
Încărcat de
Zagrean Raul-ChrisDrepturi de autor
© © All Rights Reserved
Respectăm cu strictețe drepturile privind conținutul. Dacă suspectați că acesta este conținutul dumneavoastră, reclamați-l aici.
Formate disponibile
Descărcați ca PPTX, PDF, TXT sau citiți online pe Scribd
0% au considerat acest document util (0 voturi)
303 vizualizări11 paginiProiect Fizica
Documentul prezintă definiții și exemple pentru cele trei stări de agregare: solidă, lichidă și gazoasă. De asemenea, explică transformările dintre stările de agregare, precum topirea-solidificarea, vaporizarea-condensarea, evaporarea, lichefierea, sublimarea-desublimarea. Sunt prezentate și concepte ca punctul triplu al apei și punctele critice.
Încărcat de
Zagrean Raul-ChrisDrepturi de autor
© © All Rights Reserved
Respectăm cu strictețe drepturile privind conținutul. Dacă suspectați că acesta este conținutul dumneavoastră, reclamați-l aici.
Formate disponibile
Descărcați ca PPTX, PDF, TXT sau citiți online pe Scribd