Documente Academic
Documente Profesional
Documente Cultură
Schimbari de Stare
Încărcat de
Parus BogdanDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Schimbari de Stare
Încărcat de
Parus BogdanDrepturi de autor:
Formate disponibile
Schimbari de stare
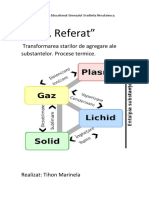
n fizic i chimie se numete stare de agregare o form a materiei caracterizat prin anumite proprieti fizice calitative, care se traduc printr-o anumit comportare la scar macroscopic. Conform tradiiei sunt cunoscute trei stri de agregare, descrise prin proprietile de volum i form:
n stare solid materia are volum i form fixe n stare lichid are volum fix, dar se adapteaz la forma vasului n care este inut n stare gazoas materia ocup ntregul volum disponibil, lund forma corespunztoare.
Aceast clasificare este ns incomplet i aproximativ: exist stri de agregare cu proprieti noi sau intermediare, cum sunt strile deplasm, cvasicristal, coloid sau i cristal lichid. Noiunea de stare de agregare este mai larg dar mai imprecis dect noiunea termodinamic de faz. n termodinamic, o faz este o component omogen a unui sistem eterogen care coexist, n echilibru termodinamic, cu alte faze. De exemplu, un sistem compus din ap i ghea const din dou faze, n dou stri de agregare diferite (una lichid i cealalt solid). Un sistem compus din ap i ulei const i el din dou faze, n aceeai stare de agregare (lichid). Un sistem compus din vin amestecat omogen cu ap are o singur stare de agregare i o singur faz.
Topirea i solidificarea
Trecerea unei substane din stare solid n lichid se numete topire. Solidificarea este fenomenul invers topirii i const n trecerea unei substane din stare lichid n cea solid. n general, topirea are loc prin absorbie de caldur (nclzire), iar solidificarea are loc prin cedare de caldur (rcire). Legile topirii i solidificrii: 1. Temperatura de topire rmne constant, dac presiunea ramne constant. La fel i pentru solidificare; 2. Temperatura de topire coincide cu cea de solidificare; 3. n timpul topirii (respectiv a solidificrii) volumul substanei se modifica astfel: majoritatea substanelor i mresc volumul la topire i i-l micsoreaz la solidificare; excepii: apa, fonta ibismutul se comport invers. Alte aspecte legate de starea de agregare:
Aliajele sunt amestecuri omogene de dou sau mai multe metale. Teperatura de topire a aliajului este mai mic dect temperatura de topire a fiecarui component al su. Masa unui corp nu se modific n timpul topirii sau al solidificrii
Vaporizarea i condensarea (lichefierea)
Trecerea unei substante din stare lichid n stare de vapori (gazoas) se numete vaporizare. Fierberea este vaporizarea care are loc n toat masa lichidului. Evaporarea este vaporizarea care are loc doar la suprafaa lichidului. Factori ce influenteaza evaporarea:
temperatura; suprafaa de ntindere: cu ct este mai mare, evaporarea are loc mai repede; agitaia aerului din jurul corpului sau substanei (vntul) grbete evaporarea. natura substanei; substane ca acetona, eterul, benzina etc. se evapor foarte repede i se numesc de aceea volatile. Evaporarea se produce cu absorbie de cldur.
Trecerea unei substane din stare de vapori n stare lichid se numete condensare sau lichefiere. Legile condensarii : 1. Condensarea are loc cu degajare de caldura(este echilibrul intre evaporare si condensare si devine vapori saturati) 2. Presiunea vaporilor saturati ai unei substante depinde doar de temperatura 3. Ca obiectele condensarii sa aiba elemente comune 4. In elementele supuse condensarii sa existe elemente contrare
Sublimarea i desublimarea
Substane ca naftalina, canforul, acidul benzotic i altele au proprietatea de a trece din stare solid direct n stare de vapori. Se spune c ele sublimeaz. Fenomenul invers, de transformare din stare de vapori direct n stare solid se numete desublimare.
Formule
1. Coeficienti calorici: Qced = Qabs; Q= mcDt 2. Caldura specific: 3. Capacitate caloric: 4. Caldura latent(puterea calorica):
S-ar putea să vă placă și
- Lacatuserie Generala MecanicaDocument604 paginiLacatuserie Generala Mecanicatanase_v94% (78)
- Desen TehnicDocument91 paginiDesen Tehniccristi0866100% (9)
- Desen TehnicDocument91 paginiDesen Tehniccristi0866100% (9)
- Transformari de Stari de AgregareDocument2 paginiTransformari de Stari de AgregareIancu Adriana100% (2)
- Transformările Stărilor de AgregareDocument25 paginiTransformările Stărilor de AgregareStanciu Ionuţ100% (2)
- Transformari de Stare de AgregareDocument33 paginiTransformari de Stare de AgregareBarna Denis Stefan100% (1)
- Transformarea Starilor de Agregare - Proiect La FizicaDocument20 paginiTransformarea Starilor de Agregare - Proiect La FizicaMadalina Ionela Stanciu78% (37)
- Stări de Agregare Ale Corpurilor Întâlnite În ViațaDocument13 paginiStări de Agregare Ale Corpurilor Întâlnite În ViațaMaraÎncă nu există evaluări
- Starea de AgregareDocument15 paginiStarea de AgregarePariș Cristea AndreeaÎncă nu există evaluări
- Transformări de Fază TermodinamicaDocument5 paginiTransformări de Fază TermodinamicaIoana100% (1)
- Transformari de Stare de AgregareDocument14 paginiTransformari de Stare de AgregareVictor Ungureanu100% (1)
- 1 Sistemul Arterial AorticDocument56 pagini1 Sistemul Arterial AorticParus Bogdan100% (2)
- Cursuri ManagementDocument23 paginiCursuri ManagementParus BogdanÎncă nu există evaluări
- Exigent Curs2008.7Document64 paginiExigent Curs2008.7Susan MargarethaÎncă nu există evaluări
- Stări de AgregareDocument2 paginiStări de AgregareAriettyAriettyÎncă nu există evaluări
- Transformarea Starilor de AgregareDocument5 paginiTransformarea Starilor de AgregareAntonioÎncă nu există evaluări
- Stari de AgregareDocument17 paginiStari de AgregareAlex ZamfirÎncă nu există evaluări
- Trasformari de Stari de AgregareDocument3 paginiTrasformari de Stari de AgregareFlorin CernatÎncă nu există evaluări
- Prezentare Fără TitluDocument4 paginiPrezentare Fără Titlumafteisamuel2008Încă nu există evaluări
- Stări de Agregare Ale Corpurilor Întâlnite În Viața CotidianăDocument7 paginiStări de Agregare Ale Corpurilor Întâlnite În Viața CotidianăRomeo Potanga100% (1)
- Referat Fizica Stsari de AgregareDocument4 paginiReferat Fizica Stsari de AgregareDanipopaÎncă nu există evaluări
- Fenomene Termice: Transformări de Stare de AgregareDocument12 paginiFenomene Termice: Transformări de Stare de AgregareMario MaiosÎncă nu există evaluări
- Stari de AgregareDocument7 paginiStari de AgregareANGELINA GEORGIANA HUZUM100% (1)
- Transformari de Stari de AgregareDocument6 paginiTransformari de Stari de AgregareSantiago PercaÎncă nu există evaluări
- Starile de AgregareDocument13 paginiStarile de Agregaremafteisamuel2008Încă nu există evaluări
- Referat ChimieDocument4 paginiReferat ChimieDoru GheorgheÎncă nu există evaluări
- Stare de AgregareDocument9 paginiStare de AgregareStroe StefanÎncă nu există evaluări
- Starile de AgregareDocument11 paginiStarile de AgregareManole AndreiÎncă nu există evaluări
- Lichide Si SolideDocument7 paginiLichide Si SolideDaniela PăvălacheÎncă nu există evaluări
- Sinteza Rapitulare Fenomene Termice 2Document10 paginiSinteza Rapitulare Fenomene Termice 2maseuruÎncă nu există evaluări
- Stari de AgregareDocument14 paginiStari de AgregareRoman JustinachoÎncă nu există evaluări
- Caldura LatentaDocument5 paginiCaldura LatentapintileirobertÎncă nu există evaluări
- Transformari de Stare de AgregareDocument7 paginiTransformari de Stare de AgregareMiha MihaelaÎncă nu există evaluări
- Proiect FizicaDocument6 paginiProiect FizicaevelynmariatrifanÎncă nu există evaluări
- Transformari de Stare de AgregareDocument33 paginiTransformari de Stare de Agregaredienusdiana100% (1)
- Stari de AgregareDocument12 paginiStari de AgregareDavid CozmaÎncă nu există evaluări
- Cap I 1.5. Transf Starilor de Agregare - Popa Mihaela Carmen - Lic. Matei BasarabDocument4 paginiCap I 1.5. Transf Starilor de Agregare - Popa Mihaela Carmen - Lic. Matei Basarabroxanaanton1988Încă nu există evaluări
- Starile de AgregareDocument4 paginiStarile de AgregareLuiza ComaniciuÎncă nu există evaluări
- Transformari Ale Starii de AgregareDocument7 paginiTransformari Ale Starii de AgregareSantiago EmanuelÎncă nu există evaluări
- Fizica 10aDocument13 paginiFizica 10aIULIANA ALEXANDRA BALASAÎncă nu există evaluări
- FarmacologieDocument6 paginiFarmacologiemihalamimi67% (3)
- Transformări de Stare de AgregareDocument5 paginiTransformări de Stare de Agregareeddyshor67% (12)
- Transformari de Stare de AgregareDocument9 paginiTransformari de Stare de AgregareRadut EduardÎncă nu există evaluări
- Prezentare 15Document11 paginiPrezentare 15Georgiana IoanaÎncă nu există evaluări
- Prezentare 15Document11 paginiPrezentare 15Georgiana IoanaÎncă nu există evaluări
- Proiect FizicaDocument11 paginiProiect FizicaZagrean Raul-ChrisÎncă nu există evaluări
- Transformarile Starilor de AgregareDocument10 paginiTransformarile Starilor de AgregareIs9t8e6fÎncă nu există evaluări
- Stari de AgregareDocument2 paginiStari de AgregareAlexandra ParaschivÎncă nu există evaluări
- Tranzitii de FazaDocument9 paginiTranzitii de FazaManea AlexandruÎncă nu există evaluări
- PfzawdDocument5 paginiPfzawdAlexandru MarceanÎncă nu există evaluări
- 5termodinamica Transformarilor Starilor de AgregareDocument2 pagini5termodinamica Transformarilor Starilor de AgregarenikialexandruÎncă nu există evaluări
- Sublimarea Si DesublimareaDocument15 paginiSublimarea Si DesublimareaTatiana ProdanÎncă nu există evaluări
- Transformarea Starilor de Agregare Ale Substantelor - Procese TermiceDocument7 paginiTransformarea Starilor de Agregare Ale Substantelor - Procese TermiceMariaÎncă nu există evaluări
- Caelev DumitruDocument7 paginiCaelev DumitruDima CaelevÎncă nu există evaluări
- Fisa FizicaDocument2 paginiFisa FizicaCristina MaricescuÎncă nu există evaluări
- Pentru FizicaDocument4 paginiPentru FizicaCristian-Mihai LupuÎncă nu există evaluări
- 8 Caldura 2018 Fisa 3 DetaliataDocument7 pagini8 Caldura 2018 Fisa 3 DetaliatapulpadecalÎncă nu există evaluări
- FIZICA - Transformari Ale Starilor de AgregareDocument6 paginiFIZICA - Transformari Ale Starilor de AgregareFilimon Cristian100% (2)
- Transformarile Starilor de AgregareDocument10 paginiTransformarile Starilor de AgregareMariana MocanuÎncă nu există evaluări
- Topire Și Solidificare, Sublimare Și DesublimareDocument11 paginiTopire Și Solidificare, Sublimare Și DesublimareIoachim Hamad-ChețanÎncă nu există evaluări
- IPMA IFR FaighelEdward Anul 1Document18 paginiIPMA IFR FaighelEdward Anul 1Răzvan ChihaiaÎncă nu există evaluări
- Proiect La Fizica.Document1 paginăProiect La Fizica.IonutÎncă nu există evaluări
- Transformari de StareDocument15 paginiTransformari de StareAndreea ManuÎncă nu există evaluări
- Starile de Agregare - ReferatDocument10 paginiStarile de Agregare - ReferatLucianÎncă nu există evaluări
- Metoda CubuluiDocument14 paginiMetoda CubuluiParus BogdanÎncă nu există evaluări
- Organe de Masini - IX - Fisa de Informare - Arbori Si OsiiDocument11 paginiOrgane de Masini - IX - Fisa de Informare - Arbori Si OsiigoreaÎncă nu există evaluări
- PrezentareDocument14 paginiPrezentareParus BogdanÎncă nu există evaluări
- Referate ChiruDocument52 paginiReferate ChiruParus BogdanÎncă nu există evaluări
- Capitolul 9.2Document4 paginiCapitolul 9.2Parus BogdanÎncă nu există evaluări
- GWP AplicatiiDocument7 paginiGWP AplicatiiParus BogdanÎncă nu există evaluări
- Chimia Si Igiena Mediului Si Alimentelor - Anul IV - Sem. IIDocument77 paginiChimia Si Igiena Mediului Si Alimentelor - Anul IV - Sem. IIVeronika TutuianuÎncă nu există evaluări
- Proiectarea Unui Atelier de Mentenanta Corectiva Pentru Un Parc de AutobasculanteDocument14 paginiProiectarea Unui Atelier de Mentenanta Corectiva Pentru Un Parc de AutobasculanteParus BogdanÎncă nu există evaluări
- Catalizator TrivalentDocument18 paginiCatalizator TrivalentParus BogdanÎncă nu există evaluări
- Document 2016 05 30 21039024 0 Ghid Afacere Service Auto PDFDocument23 paginiDocument 2016 05 30 21039024 0 Ghid Afacere Service Auto PDFDavid Daniel TudorieÎncă nu există evaluări
- Indrumar de Proiectare MotoareDocument121 paginiIndrumar de Proiectare MotoareDorinel EuÎncă nu există evaluări
- Nicolae ScuDocument20 paginiNicolae ScuParus BogdanÎncă nu există evaluări
- Referat Airbag AudiDocument32 paginiReferat Airbag AudiSorin SchiopuÎncă nu există evaluări
- Prelegerea EADocument15 paginiPrelegerea EAParus BogdanÎncă nu există evaluări
- Prelegerea 1 EA PDFDocument11 paginiPrelegerea 1 EA PDFSilviu ScarlatÎncă nu există evaluări
- Curs de Legislatie Rutiera: Expresii Si TermeniDocument74 paginiCurs de Legislatie Rutiera: Expresii Si TermeniParus BogdanÎncă nu există evaluări
- Cinematica PistonuluiDocument6 paginiCinematica PistonuluiCristi IversonÎncă nu există evaluări
- Referat Airbag AudiDocument32 paginiReferat Airbag AudiSorin SchiopuÎncă nu există evaluări
- CerebelulDocument62 paginiCerebelulMadalina MadiÎncă nu există evaluări
- Celula VegetalaDocument22 paginiCelula VegetalaMuscaSergiu100% (1)
- Conservarea ImpulsuluiDocument3 paginiConservarea ImpulsuluiParus BogdanÎncă nu există evaluări
- Formular AtestareDocument1 paginăFormular AtestareParus BogdanÎncă nu există evaluări
- Conservarea EnergieiDocument2 paginiConservarea EnergieiParus BogdanÎncă nu există evaluări