Documente Academic
Documente Profesional
Documente Cultură
Ognean Fiziologiaidezvoltareapulmonar
Încărcat de
Andreea Lavinia Voicu0 evaluări0% au considerat acest document util (0 voturi)
29 vizualizări71 paginiTitlu original
Ognean_Fiziologiaidezvoltareapulmonar (1)
Drepturi de autor
© © All Rights Reserved
Formate disponibile
PPTX, PDF, TXT sau citiți online pe Scribd
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca PPTX, PDF, TXT sau citiți online pe Scribd
0 evaluări0% au considerat acest document util (0 voturi)
29 vizualizări71 paginiOgnean Fiziologiaidezvoltareapulmonar
Încărcat de
Andreea Lavinia VoicuDrepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca PPTX, PDF, TXT sau citiți online pe Scribd
Sunteți pe pagina 1din 71
Fiziologia și dezvoltarea pulmonară.
Particularitățile plămânului prematur
Conf. Univ. Dr. Maria Livia Ognean
Spital Clinic Judeţean de Urgenţă Sibiu
Facultatea de Medicină, Universitatea Lucian
Blaga Sibiu
Introducere
• Funcția aparatului respirator - asigurarea
respirației, respectiv a schimbului de gaze –
oxigen-dioxid de carbon
– începe imediat după naștere.
• Componentele sistemului respirator
– căi respiratorii superioare și inferioare, plămâni,
cutie toracică cu musculatura aferentă, diafrag
– sunt prezente la naștere
– maturarea structurală și funcțională a acestora
continuă și după naștere ceea ce
particularizează aparatul respirator neonatal
comparativ cu alte vârste
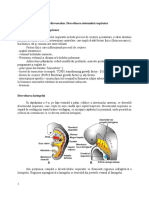
Noțiuni introductive de anatomie a
aparatului respirator
• respirația nou-născutului este de tip
nazal
• limba relativ mare față de cavitatea
bucală și bula lui Bichat îngreunează
respirația pe durata suptului.
• Căile respiratorii superioare
– nasul și cavitățile nazale, cavitatea
bucală, sinusurile paranazale, nazo-
faringele, hipofaringele și laringele
– direcționează aerul spre plămâni și
asigură încălzirea, umidifierea
(datorită patului vascular bogat) și
filtrarea acestuia (funcția firelor de
păr, a stratului de mucus și a
structurilor ciliare de pe suprafața
căilor respiratorii).
Noțiuni introductive de anatomie a
aparatului respirator
• Căile respiratorii inferioare
– se extind de la trahee la alveolele
pulmonare
– traheea - scurtă (la termen are 4 cm),
mai puțin rigidă și mai mobilă față de
adult, bifurcându-se la nivelul vertebrei
toracice 3
– bronhia principală dreaptă ceva mai
sus de cea stângă
– bronhiile principale se divid în bronhii
lobare, apoi în bronhii segmentare,
conducte respiratorii, bronhiole
terminale, bronhiole respiratorii, ducte
alveolare și, în final, alveole
Noțiuni introductive de anatomie a
aparatului respirator
• Căile respiratorii inferioare
– unitatea respiratorie pulmonară -
formată din trei ordine de bronhiole
respiratorii, o generație (punct de
diviziunea căilor respiratorii) de
conducte alveolare și sacii alveolari
terminali
– arborele respirator uman prezintă în
medie 23 de generații de căi respiratorii
și 16 generații de bronhiole terminale
– diviziunile distale – bronhiolele
respiratorii, conductele alveolare și
alveolele pulmonare – sunt cele
specializate în schimbul de gaze.
Noțiuni introductive de anatomie a
aparatului respirator
• Căile respiratorii neonatale au diametru mult mai mic
comparativ cu cele ale adultului de aceea rezistența la
fluxul aerian este mai mare (de 15 ori), mai ales la
nivelul căilor respiratorii mici.
• Laringele, traheea și bronhiile nou-născutului au conținut
mai mic de cartilagiu ceea ce le crește complianța.
• Cartilajul este prezent până la nivelul bronhiolelor, în
restul căilor respiratorii mici predominând țesutul elastic
ceea ce crește riscul de colaps expirator.
Noțiuni introductive de anatomie a
aparatului respirator
• Tractul respirator prezintă epiteliu respirator pseudostratificat
format din:
– celule epiteliale ciliate columnare
– celule calciforme (goblet) și
– celule bazale (stem)
– dar epiteliul respirator variază de la o regiune la alta,
adaptat funcțiilor fiecărei regiuni.
• Celulele ciliate au rolul de a deplasa mucusul și particulele de
praf din aerul inspirat spre laringe pentru a fi eliminate sau
înghiţite
• Celulele caliciforme produc mucus cu rol protector şi de
filtrare a particulelor din aer.
Noțiuni introductive de anatomie a
aparatului respirator
• Plămânul drept este mai mare decât cel stâng și are 3
lobi – superior, mijlociu și inferior – spre deosebire de cel
stâng care are doar doi lobi – superior și inferior -.
• Lobii pulmonari sunt subdivizați în segmente pulmonare,
10 în dreapta și 8 în stânga.
• Plămânul neonatal este mai rigid și mai puțin compliant
față de cel al adultului.
Noțiuni introductive de anatomie a
aparatului respirator
• Nou-născutul prezintă doar circa 10% din numărul de alveolele
pulmonare de la vârsta adultă.
• Alveolele pulmonare sunt separate de septurile interalveolare care
cuprind capilarele alveolare.
• La nivelul alveolelor pulmonare există 3 tipuri de celule alveolare:
– pneumocitele de tip I (cu rol structural)
– pneumocitele de tip II (care secretă surfactant) și
– macrofage alveolare.
• La nou-născut, chiar și la termen, procesul de alveolizare este în curs
de desfășurare, pereții alveolari și ai capilarelor alveolare sunt mai
groși, îngreunând difuziunea gazelor.
• Distanța alveolo-capilară este și mai mare în cazul copiilor născuți
prematur.
• Suprafața de schimb gazos crește de la 2,8 m2 la nou-născutul la
termen la 32 m2 la vârsta de 8 ani şi atinge 75 m2 la adult.
Noțiuni introductive de anatomie a
aparatului respirator
• Toracele neonatal este cilindric, format din coaste
cartilaginoase, orizontalizate
• Mușchii intercostali sunt slab dezvoltați la naștere
(toracele este foarte compliant, ușor deformabil) și
participă foarte puțin la creșterea volumelor
respiratorii.
• Mecanismele compensatorii ale nou-născutului în
cazul problemelor respiratorii sunt:
– creșterea frecvenței respiratorii
– creșterea efortului respirator.
• Rezultat: în inspir apar retracțiile (tirajul) intercostal,
subcostal, suprasternal și supraclavicular și, în
suferințele respiratorii severe, respirația paradoxală
– balansul toraco-abdominal.
Noțiuni introductive de anatomie a
aparatului respirator
• Diafragmul - cel mai important mușchi respirator este inserat
orizontal la nou-născut iar contracția diafragmului dincolo de
punctul în care cupola diafragmatică este aplatizată duce la
mișcarea spre interior a coastelor.
– diafragmul nou-născutului are mai puține fibre musculare de
tip I, rezistente la fatigabilitate (rezultat - oboseală mai rapidă
a diafragmului)
• Mușchii intercostali neonatali sunt imaturi, au fibre musculare
fără rexistență la fatigabilitate fiind ineficienți în suplimentarea
respirației.
• Particularitățile morfo-funcționale ale diafragmului și mușchilor
respiratori predispun nou-născutul la oboaselă musculară și
cresc riscul de insuficiență respiratorie.
Noțiuni introductive de anatomie a
aparatului respirator
Noțiuni introductive de anatomie a
aparatului respirator
Noțiuni introductive de anatomie a
aparatului respirator
Noțiuni de embriologie și dezvoltarea
intrauterină
• Dezvoltarea aparatului respirator începe în primele 3 săptămâni
de viață embrionară.
– plămânul are originea embrionară în endodermul ventral al
intestinului primitiv
– țesutul de susținere are origine mezodermică
• Etapele dezvoltării pulmonare sunt influențate de factori fizici, de
mediu, hormonali și genetici şi de interacţiunea dintre celulele
care provin din două straturi germinale - endoderm şi
mezoderm.
• Din momentul formării, în viața intrauterină, plămânul continuă
să crească până la vârsta de adult când:
– suprafața de schimb gazos pulmonar atinge 70-100 m2
– bariera aer/sânge are grosime de 0,2µ.
Noțiuni de embriologie și dezvoltarea
intrauterină
• Dezvoltarea pulmonară continuă de la apariția mugurelui pulmonar
până în copilăria timpurie
• Practic, dezvoltarea pulmonară se desfășoară în 2 stadii: pre- și
postnatal, la naștere plămânul nefiind încă matur. (Nici în prezent nu
se poate spune cu exactitate în ce moment plămânul ajunge la
maturitate.)
• Dezvoltarea prenatală a plămânului are loc în decursul a 5 perioade
delimitate în baza caracteristicilor anatomice și histologice
Noțiuni de embriologie și dezvoltarea
intrauterină
• perioada embrionară
– săptămânile fetale 3-7, zilele 26-52
– apariția structurilor saculare care vor forma apoi bronhiile
primare, secundare, segmentale și subsegmentale
– în paralel se dezvoltă și arterele pulmonare aferente
(derivate din arcul 6 aortic)
– în săptămâna a 5-a sunt formați și toți lobii pulmonari
– anomaliile de dezvoltare din această perioadă pot da naștere
unor malformații precum agenezia pulmonară,
atrezia/stenoza laringeală sau traheală, traheo/bronho-
malacia, fistula eso-traheală, ectopia lobară, chisturile lobare
congenitale, malformații bronșice, ectopii de lobi pulmonari;
Noțiuni de embriologie și dezvoltarea
intrauterină
• perioada pseudoglandulară
– săptămânile fetale 6 (ziua 52)-17
– apariția bronhiolelor terminale prin diviziune rapidă
– vasele sangvine continuă să se dezvolte în paralel cu căile
aeriene, ramificațiile fiind similare cu ale adultului la finele acestei
perioade
– în paralel se dezvoltă și inervația structurilor pulmonare
– în fazele inițiale au loc și apariția diafragmului și separarea cavității
pleuro-pulmonare în cavitate pleurală și cavitate peritoneală
– are loc diferențierea celulelor epiteliale pentru formarea structurilor
cartilaginoase, a glandelor submucoase, a celulelor musculare
netede și a epiteliului respirator (celule columnare ciliate și
calciforme)
– anomalii ale dezvoltării în această perioadă pot determina
hipoplazia și sechestrarea pulmonară, malformația adenomatoidă
chistică pulmonară, emfizemul lobar congenital, chisturi
pulmonare, limfangiectazia pulmonară congenitală, hernia
Noțiuni de embriologie și dezvoltarea
intrauterină
• perioada canaliculară
– săptămânile fetale 17-26
– apariția capilarelor pulmonare
– continuarea ramificării și dezvoltării căilor aeriene distale
(alveole și saci alveolari rudimentari)
– subțierea progresivă a mezenchimului pulmonar
– apariția membranei alveolo-capilare
– diferențierea celulelor epiteliale de tip I cuboide în celule de
tip II scuamoase (pas important în secreția de surfactant
inițiată în această perioadă)
– formarea barierei alveolo-capilare
– prezența unor mase intratoracice sau modificări de forțe
fizice de la acest nivel (date de lichidul pulmonar sau
respirația fetală) pot da naștere hipoplaziei pulmonare;
Noțiuni de embriologie și dezvoltarea
intrauterină
• perioada saculară
– săptămânile fetale 24-38
– dilatarea marcată a căilor aeriene terminale și formarea de
saci alveolari
– creșterea considerabilă a parenchimului și volumului
pulmonar și a suprafeței de schimb gazos
– subțierea în continuare a membranei alveolo-capilare
– modificarea rețelei de microcapilare
– inițierea formării alveolelor pulmonare;
Noțiuni de embriologie și dezvoltarea
intrauterină
• perioada alveolară
– 36 săptămâni fetale – 3 ani după naștere
– formarea de septuri secundare
– continuarea dezvoltării rețelei capilare
– continuarea proliferării și dezvoltării alveolelor pulmonare
– membrana alveolo-capilară se subțiază și mai mult
– crește accelerat suprafața de schimb gazos, favorizând
schimbul rapid de gaze
– formarea alveolelor pulmonare începe din perioada
anterioară și continuă până la atingerea unui număr final de
alveole de 200-300 milioane (până la 8 ani).
Noțiuni de embriologie și dezvoltarea
intrauterină
Noțiuni de embriologie și dezvoltarea
intrauterină
Noțiuni de embriologie și dezvoltarea
intrauterină
Fiziologie pulmonară neonatală
• Funcția pulmonară – respirația – presupune, în esență,
asigurarea organismului cu O2 și înlăturarea CO2 produs în
metabolismul celular, necesită funcționarea simultană a
aparatului respirator și a celui cardio-circulator și se desfășoară
în trei etape principale:
– ventilația pulmonară (introducerea ritmică de gaze proaspete
în alveole)
– difuzia O2 și CO2 la nivelul membranei alveolo-capilare
– perfuzia capilară care transportă O2 și CO2 la și de la
țesuturi.
• Transferul de O2 din aerul atmosferic se realizează datorită
diferențelor de presiune și concentrație. Aerul atmosferic este
format din oxigen 21%, dioxid de azot 78% și dioxid de carbon,
argon și heliu 1% și are presiune totală de 760 mmHg.
Fiziologie pulmonară neonatală
• Adaptarea respiratorie și cardio-vasculară la naștere - un proces lent
• Un pas important - eliminarea lichidului pulmonar fetal (secretat din
săpt. 6-8 de gestație, cu rol crucial în dezvoltarea plămânului)
– trecerea de la respirația lichidiană fetală la cea aeriană este pregătită de
modificări hormonale spre finalul sarcinii și în timpul travaliului
– eliminarea lichidului pulmonar începe dinainte de naștere și continuă
postnatal sub influența secreției de adrenalină (inhibă secreția de lichid
pulmonar și stimulează resorbția acestuia în interstițiul pulmonar)
– la eliminarea lichidului alveolar fetal participă și mișcările fetale, începând
cu câteva zile înainte de naștere
– în timpul travaliului, forțele mecanice, comprimarea și întinderea toracelui
în timpul trecerii prin canalul pelvi-genital au rol în eliminarea lichidului
pulmonar
– în anumite situații poate avea loc o resorbție redusă a lichiului pulmonar:
operația cezariană electivă în absența travaliului, asfixie la naștere,
clamparea întârziată a cordonului ombilical.
Fiziologie pulmonară neonatală
Controlul respirației
• în viața intrauterină fătul prezintă mișcări respiratorii intermitente de la
vârsta de 12 săptămâniț
• respirația fetală este predominant diafragmatică, periodică, alternând
cu perioade de apnee
• respirațiile fetale devin ritmice și mai ample pe măsura dezvoltării și
maturării centrilor respiratori, ajungând la un ritm de 30-70
respirații/minut iar spre finalul sarcinii prezintă chiar un ritm circadian
(mai reduse dimineața devreme, mai intense după amiaza).
• ritmul respirației este determinat de alternarea impulsurilor neuronilor
inspiratori și expiratori din regiunea bulbului și punții, controlul
respirației dezvoltându-se progresiv în sarcină dar și după naștere
până la vârsta de 1 an
Fiziologie pulmonară neonatală
Controlul respirației
• grupurile neuronale din nivelul centrului respirator au funcții de
inspir/expir variabil conturate, rolul centrului fiind rezultatul interacțiunii
acestor grupuri neurolonale care determină alternarea inspirului cu
expirul
• ritmul respirator normal dar și alte tipuri de respirație precum suspinul
și gasp-ul sunt controlate de aceleași grupuri neuronale
• controlul automat ale respirației se află la nivelul trunchiului cerebral și
al punții lui Varolio.
• respirația de tip gasp este caracterizată de un inspir intempestiv,
sacadat, asociat cu mișcări spasmodice ale mandibulei, urmate de
pauze respiratorii lungi care pot preceda oprirea respirației; acest tip
de respirație este considerat a fi un mecanism important pentru
supraviețuire, o tendință de re-inițiere a ritmului normal al respirației
Fiziologie pulmonară neonatală
Controlul respirației
• reglarea umorală a respirației este determinată de efectul concentrației
de O2 și CO2 în sânge și al pH-ului sagvin asupra centrilor respiratori,
efect exercitat prin intermediul chemoreceptorilor centrali și periferice.
• chemoreceptorii sunt sensibili la hipoxie și hipercapnie și, în aceste
condiții, stimulează centrii respiratori determinând creșterea frecvenței și
amplitudinii respirației
• se presupune că chemoreceptorii centrali sunt localizați la nivelul la care
nervii cranieni IX și X ies din creier iar cei periferici sunt corpusculul
carotidian și cel aortic; la nou-născut, corpusculul carotidian, implicat
mai ales în răspunsul hipoxic, este imatur la naștere, sensibilitatea sa la
hipoxie crescând după naștere
• sensibilitatea la hipoxie a chemoreceptorilor este redusă prenatal
• hiperoxemia și hipocapnia asociate resuscitării neonatale cu oxigen
100% (comparativ cu aer atmosferic) pot astfel explica întârzierea
apariției primei respirații.
Fiziologie pulmonară neonatală
Prima respirație a nou-născutului este rezultatul acțiunii unui complex de
factori:
• comprimarea și decomprimarea toracelui neonatal la trecerea prin
canalul pelvi-genital matern
• întreruperea circulației feto-placentare cu întreruperea furnizării de O2
și acumulare de CO2 (determinând stimularea chemoreceptorilor și a
centrilor respiratori)
• stimularea senzorială (aerul rece și curenții de aer, lumina, zgomotul,
atingerea, durerea) care excită reflex centrii respiratori.
Primele respirații sunt scurte și sacadate fiind urmate de respirații cu inspir
redus și expir prelungit.
Mecanica pulmonară
Ventilația pulmonară
• = totalitatea proceselor mecanice care asigură schimbul de gaze
dintre aerul atmosferic și plămâni
• se obține în timpul expansiunii pulmonare (inspir), concomitent având
loc creșterea capacității intratoracice
• respirația are loc în două faze – inspir și expir – care se succed ritmic
• ventilația (respirația spontană) depinde de:
– proprietățile elastice ale parenchimului pulmonar
– caracteristicile cutiei toracice
– caracteristicile aerului inspirat
• plămânul își modifică volumul și forma în funcție de schimbările de
volum și formă ale cutiei toracice; în repaus există un echilibru,
tendința cutiei toracice de a se expansiona este contracarată de
tendința plămânului de a colaba.
Mecanica pulmonară
Inspirul
• inițiat de centrul respirator ca urmare a stimulilor de la chemoreceptori
• reprezintă partea activă a respirației
• impulsurile sosite de la centrii respiratori determină:
– contracția mușchilor respiratori
– expansiunea cutiei toracice
– creșterea consecutivă a volumului toracic și expansiunea plămânilor
– creșterea presiunii intrapleurale și intraalveolare
– scăderea presiunii intrapleurale și alveolare (cu 3-5 mmHg sub presiunea
atmosferică)
• gradientul presional între nas și gură și respectiv alveolele pulmonare
determină intrarea aerului în CR până la egalizarea presiunilor
• datorită particularităților cutiei toracice și musculare neonatale inspirul
determină apariția retracțiilor intercostale și subcostale în inspir
Mecanica pulmonară
Mecanica pulmonară
Expirul
• reculul elastic pulmonar, relaxarea mușchilor respiratori determină, în
expir:
– scăderea volumului toracelui
– comprimarea plămânului
– creșterea presiunii intrapleurale și alveolare
– reapariția unui gradient presional – presiunea alveolară fiind cu 3-5 mmHg
mai mare decât cea atmosferică
• un proces pasiv care tinde să egalizeze din nou presiunile prin
direcționarea fluxului de gaz dinspre alveole spre exterior
• expirul încetează în momentul dispariției gradientului presional
• faza de expir este direct proporțională cu intensitatea expansiunii pe
durata inspirului
• în caz de tuse, strănut și în unele situații patologice pot interveni și
mușchii expiratori, mai ales cei abdominali
Mecanica pulmonară
Mecanica pulmonară
• Volumul tidal (VT) este volumul de aer vehiculat în cursul
unei respirații normale, de repaus, fără efort
– cea mai mare parte a VT este asigurată, în respirația normală, de
contracția diafragmului
– volumul tidal este de 6-8 (10) ml/kgc la nou-născutul la termen și
de 4-6 ml/kgc la prematuri.
• Capacitatea reziduală funcțională (CRF) (volumul de
repaus) este volumul pulmonar existent în situația de
echilibru al acestor două forțe, respectiv volumul de gaz
care rămâne în plămâni după un expir normal
– la nou-născut CRF este de 20-30 ml/kgc.
Mecanica pulmonară
• Adesea, în timpul primelor respirații de după naștere fluxul
expirator este întrerupt ceea ce duce la creșterea presiunii
intratoracice și în căile aeriene (auto-recrutare)
• Închiderea parțială a glotei în expir, stimularea mușchilor
inspiratori în timpul expirului și blocarea reculului pasiv al
diafragmului pot produce aceste întreruperi ale fluxului expirator
care au rolul de a crește volumul de gaz intrapulmonar la finalul
expirului și de obținere a CRF, indiferent de VG și de modul
nașterii (în primele 2-3 ore de viață la copiii născuți la termen pe
cale vaginală și în 5-6 ore la cei extrași prin operație cezariană)
Mecanica pulmonară
• Prematurii au CRF relativ redusă chiar și în prezența unei cantități de
surfactant datorită:
– unor micro-atelectazii difuze datorate imaturității structurilor
pulmonare
– tendinței de colabare și închidere precoce a căilor respiratorii
(ceea ce predispune la apariția sindroamelor de pierdere de aer)
• CRF crește în obstrucțiile căilor severe, când aerul nu poate fi eliminat
din plămâni
• Creșterea CRF se asociază cu hiperinflație pulmonară
• Scăderea CRF apare în:
– afecțiunile pulmonare restrictive
– afecțiuni cu distensie absominală marcată
– paralizia diafragmului
– decubit dorsal.
Mecanica pulmonară
• Frecvența respiratorie normală a nou-născutului este de 30-40
respirații/minut.
• Volumul rezidual este volumul care rămâne în plămâni după o
respirație forțată, la nou-născut fiind de 2 ml/kgc.
• Capacitatea vitală este volumul maxim de aer care poate fi
inspirat după un expir complet, la nou-născut fiind de 40 ml/kgc.
• Capacitatea totală este suma capacității vitale și a volumului
rezidual.
• Minut-ventilația este cantitatea de aer proaspăt ventilat în căile
respiratorii într-un minut și se calculează înmulțind volumul tidal
cu frecvența respiratorie, la nou-născut având valori de 210-230
ml/kgc/minut.
Mecanica pulmonară
• Spațiul mort anatomic = volumul de gaz aflat în CR
preacinare, unde nu au loc schimburi de gaze
– are un volum relativ constant, de 2-2,5 ml la nou-născut
(aproximativ 1/3 din VT)
• Alveolele ventilate dar neperfuzate reprezintă spațiul mort
alveolar
• Spațiul mort fiziologic = suma spațiului mort anatomic și
alveolar, reprezintă aproximativ 30-50% din VT.
• Volumul (capacitatea) de închidere = volumul pulmonar la
care CR terminale încep să colabeze
– la nou-născutul bolnav acest volum poate fi uneori mai mare decât
CRF ceea ce înseamnă că alveolele nu pot fi păstrate deschise în
inspir și în expir, cu hipoxemie și hipercarbie secundare.
Mecanica pulmonară
• Volumul alveolar = spațiul în care au loc schimburile de
gaze (bronșiole, canale alevolare și alveole)
– la nou-născut are de 4 ml
– volumul alveolar se calculează scăzând spațiul mort din VT.
• Ventilația alveolară este produsul dintre volumul alveolar și
frecvența respiratorie
– circa 140 ml/kgc la nou-născut.
Particularități ale nou-născutului și
prematurului
• stabilitatea cutiei toracice este facilitată de poziția relativ orizontală a
coastelor ceea ce face ca contracția mușchilor intercostali simultan cu
cea a diafragmului conferă mai degrabă o rigiditate decât expansiune
• contracția diafragmatică este mai puțin eficientă decât la adult; la
prematuri structura diafragmului este diferită, conținând o proporție
mai mare de fibre care se contractă rapid și obosesc repede
(comparativ cu cele cu contracție mai lentă și rezistență la oboseală)
• osificarea redusă a coastelor și sternului prematurilor și
funcționalitatea imatură a mușchilor intercostali cresc tendința de
colabare a cutiei toracice în inspir; acesta duce la efort crescut al
diafragmului (excursiile diaframatice cresc pentru a contrabalansa
mișcările paradoxale ale cutiei toracice) și epuizarea funcției
respiratorii la prematurii cu sindrom de detresă respiratorie prin deficit
de surfactant (SDRDS).
Proprietățile elastice ale plămânilor
Complianța (C) - o valoare care exprimă elasticitatea (distensibilitatea)
plămânului, cutiei toracice sau a întregului sistem respirator
• definită de corelația dintre presiunea aplicată alveolelor (P) pentru
asigurarea variațiilor de volum (V): C = V/P (volumul de gaz schimbat
pe unitatea de presiune)
• reprezentată grafic sub forma unei curbe presiune volum în care cu
cât complianța este mai mare cu atât mai mare este cantitatea de gaz
pulmonar pe unitatea de presiune și curba este mai abruptă
• C pulmonară redusă necesită presiuni mai mari pentru a produce
modificări de volum
• în general C este proporțională cu VG
• la termen C totală a sistemului respirator este de 3-6 ml/cmH2O
• C crescută a peretelui toracic al prematurului crește riscul de colabare
alveolară la finalul expirului și de atelectazie secundară.
Proprietățile elastice ale plămânilor
Complianța pulmonară normală neonatală versus complianța pulmonară în SDRDS
Proprietățile elastice ale plămânilor
• Elasticitatea pulmonară este determinată de prezența fibrelor elastice
din parenchimul pulmonar și de forțele de tensiune superficială de la
nivelul alveolelor.
• Surfactantul - substanță tensio-activă care reduce forțele de tensiune
superficiale și permite astfel stabilizarea dimensiunilor alveolelor
pulmonare
– conform legii Laplace, presiunea necesară menținerii expansiunii
alveolare (P) = 2 X tensiunea superficială/raza alveolei
– ca atare, presiunea de expansiune alveolară crește proporțional cu
raza alveolei ceea ce înseamnă că alveolele mai mici se vor goli în
cele mai mari
– surfactantul, diminuând tensiunea superficială, este mai eficient
când alveolele au dimensiuni mai mici (ca urmare a unei
concentrații mai mari de surfactant) ceea ce face ca presiunea
intra-alveolară să fie uniform menținută la nivelul parenchimului
pulmonar și alveolele sunt menținute la dimensiuni stabile
Proprietățile elastice ale plămânilor
Ilustrarea legii Laplace la nivelul alveolelor pulmonare
Efectul administrării de surfactant asupra complianței pulmonare
Proprietățile elastice ale plămânilor
Efectele administrării de surfactant:
• crește presiunea de deschidere
• expansiunea pulmonară este mai mare la aceiași presiune maximă
• scade tendința de colaps în expir
• scade efortul respirator (plămânul este mai ușor de destins)
• crește CRF (secundar scăderii tendinței la colaps)
• efect anti-edematos - secundar scăderii tensiunii superficiale alveolare
este atrasă apa din capilare în alveole
• stabilizarea dimensiunilor alveolelor.
• alveolele stabilizate au tendința de a se susține reciproc: dacă o
alveolă are tendință la colaps, forța exercitată pe pereții alveolelor
vecine crește și aceasta permite evitarea colapsului alveolar.
Proprietățile elastice ale plămânilor
• Complianța statică reflectă
proprietățile elastice ale plămânului
– se măsoară în condițiile unui flux
absent de gaze, evaluând presiunea
transpulmonară (presiunea alveolară
minus cea pleurală) înainte și după
inflarea plămânului cu un volum
cunoscut de gaz
– evaluările cu volume diferite permit
obținerea curbelor presiune-volum
corespunzătoare
• În schimb, complianța dinamică se
măsoară un prezența unui flux de
gaze în căile respiratorii
– se ameliorează când afecțiunea
pulmonară se ameliorează și scade în
cazul agravării acesteia
Proprietățile elastice ale plămânilor
Aria aplatizată A a curbei
corespunde afecțiunilor
caracterizate de atelectazie
(pneumonie, detresa respiratorie
prin deficit de surfactant) - la
volume pulmonare scăzute, C este
scăzută și se produc mici
schimbări de volum la mari variaţii
de presiune (hipoinflaţie
pulmonară) fiind nevoie de
presiuni mari pentru deschiderea
căilor aeriene terminale şi a
alveolelor atelectatice.
Proprietățile elastice ale plămânilor
• Aria B a curbei (verticală) corespunde
respiraţiei normale, cu eficienţa
mecanică maximă, când C este
crescută și la schimbări mici de
presiune au loc schimbări mari de
volum.
• Aria C a curbei corespunde afecțiunilor
pulmonare caracterizate de
supradistensie (aspiraţie de meconiu
cu retenţie de aer, de exemplu) sau în
cazul utilizării de presiuni mari de
distensie în ventilaţia mecanică; apar
mici schimbări de volum la mari variaţii
presionale iar creşterea în continuare a
presiunii de ventilaţie poate determina
barotraumă.
Rezistența căilor aeriene
• Rezistența căilor aeriene = forța care trebuie învinsă pentru a se
putea realiza ventilația; forțele generate de presiunea creată de
elasticitatea cutiei toracice și a plămânilor tind să determine
revenirea acestora la poziția inițială, dinainte de inspir
• Termenul de rezistență a CR este folosit pentru a defini raportul
dintre diferența de presiune dintre alveole și gură și fluxul care apare
secundar:
R (cmH2O/L/sec) = ΔP(cmH2O) / V (L/sec)
• Aproximativ 40% din rezistența sistemului respirator provine de la
nivelul nasului, oro-faringelui și faringelui
• La nivelul traheei și arborelui bronșic, structurile cele mai rezistente
la fluxul de aer sunt bronhiile de talie medie și căile aeriene cele mai
mici
Rezistența căilor aeriene
• Factorii care determină rezistența (R) dintr-un tub sunt lungimea (l)
și raza tubului (r) și tipul de flux (laminar sau turbulent): R = l/r
• În aparatul respirator, fluxul turbulent apare mai ales la nivelul
ramificațiilor sau acolo unde fluxul aerian este mare și raza tubului
este mare
• Fluxul turbulent generează rezistență mai mare față de cel laminar.
• Volumul pulmonar este un al factor important în rezistența CR la flux
• Rezistența la flux depinde și de densitatea și vâscozitatea gazului
inspirat.
• Rezistența CR este mai mică în inspir comparativ cu expirul datorită
modificărilor de presiune transtoracică
Rezistența căilor aeriene
• Rezistența totală în căile aeriene și țesutul pulmonar la nou-
născutului sănătos care respiră spontan este de 20-40 cm H2O/l/sec
în timp ce la nou-născutul intubat este de 50-150 cm H2O/l/sec
• Creșterea rezistenței la flux la nou-născutul intubat este determinată
de:
– filtre
– fluxul de gaz
– valva de expir a ventilatorului
– prezenţa apei în circuitul pacientului
– dar mai ales de diametrul şi lungimea sondei endotraheale
• Fluxul generat de respiraţia spontană la nou-născut este de 0,6 –
9,9 l/min și variază de-a lungul căilor respiratorii (fiind minim la
nivelul căilor respiratorii periferice unde tinde să devină laminar și
maxim la nivelul traheei)
Rezistența căilor aeriene
• Presiunea de deschidere este presiunea la care alveolele pulmonare
încep să se deschidă.
• Constanta de timp respiratorie exprimă cât de rapid este inflat sau
evacuat plămânul, respectiv timpul necesar pentru ca volumul
plămânului să atingă 63% din volumul său maxim, atât în inspir cât
şi în expir
– depinde de C și R
– plămânii unui nou-născut sănătos cu C și R în CR de 30 cm
H2O/l/s au o constantă de timp de 0,12 secunde
– umplerea, respectiv evacuarea plamânului este completă (95%-
99%) după 3-5 constante de timp
– plămânul cu C scăzută are constantă de timp scurtă (inspir și
expir scurte față de plămânul normal) iar plămânul cu R crescută
are constantă de timp crescută.
Ventilația alveolară
• Ventilația alveolară (VA) este volumul de aer proaspăt care intră în
aparatul respirator în fiecare minut și este disponibil pentru schimbul
de gaze
– reducerea expansiunii pulmonare, ca în SDRDS, duce la scăderea VT și a VA
pentru că spațiul mort rămâne neschimbat
– fiziologic CRF neonatală este de 20-30 ml/kgc
– cu fiecare respirație doar 1/5-1/6 din aerul alveolar este schimbat cu aer atmosferic
proaspăt.
• Variațiile presiunilor parțiale ale O2 și CO2 din alveole sunt
determinate de echilibrul dintre VA, consumul de O2 și producția de
CO2.
• VA este reglată de centrii respiratori pentru a menține PaCO2 în jur de
40 mmHg și PaO2 în jur de 100 mmHg
Ventilația alveolară
• PaCO2 este în mod normal identică cu PCO2 alveolară (PACO2) și
este invers proporțională cu gradul de ventilație și este folosită ca
indicator de ventilație alveolară:
– dacă VA scade la jumătate se va dubla pACO2
– dacă VA crește de 2 ori atunci PaCO2 scade la jumătate
• Variațiile PaO2 sunt și ele proporționale cu gradul de ventilație și
invers proporționale cu PaCO2 pentru că suma presiunilor parțiale ale
gazelor din alveole este totdeauna 760 mmHg (presiunea parțială a
vaporilor de apă nu variază iar cea a azotului variază foarte puțin)
• Cu toate acestea PaO2 nu este un bun indicator de VA pentru că
valoarea sa variază și în funcție de prezența shunt-urilor
intrapulmonare.
Difuziunea
• difuziunea este următorul pas în reînnoirea ciclică a aerul alveolar
• reprezintă trecerea O2 din alveole în sânge și a CO2 din sânge în
alveole, de la presiuni parțiale mai mari spre partea cu presiune
parțială mai mică (difuziune fizică pasivă).
• legea lui Fick - volumul de gaze care difuzează pe unitatea de timp
(Vgaz) este proporțional cu aria suprafeței (A) la o constantă de
difuziune (K) și cu diferența dintre presiunile parțiale (P1-P2) și invers
proporțională cu grosimea peretelui alveolar:
Vgaz = A X K X (P1-P2) / S
Difuziunea
• Constanta de difuziune este proporțională cu solubilitatea gazului și
invers proporțională cu pătratul greutății moleculare a gazului
• Greutățile moleculare ale O2 și CO2 nu sunt foarte diferite dar CO2
are solubilitate mai mare așa că difuziunea CO2 este de circa 20 de
ori mai rapidă față de cea a O2
• La nivelul barierei sânge-aer presiunea parțială a O2 este de circa 60
mmHg (100 la nivel alveolar – 40 de la nivelul sângelui venos capilar)
• Durata de timp necesară echilibrării CO2 capilar cu cel alveolar este
aproximativ aceiași cu cea necesară echilibrării O2 chiar dacă CO2
difuzează mai rapid datorită particularităților hemoglobinei.
Circulația pulmonară
• Grosimea musculaturii arterei pulmonare crește în ultimul sfert de
sarcină blocând perfuzia din circulația pulmonară care se dezvoltă
rapid
• Dezvoltarea rapidă a circulației pulmonare determină reducerea
graduală a RVP
• Gradul dezvoltării circulației pulmonare afectează aspectul clinic al
afecțiunilor cardio-respiratorii neonatale atunci când alterările
ventilație/perfuzie sunt determinate de modificări ale capacității de
creștere a rezistenței vasculare la stimuli precum hipoxia și acidoza.
• În condiții fiziologice raportul vetilație/perfuzie (VA/Q) este de 700-800
ml/minut (0,8-1 față de adult)( debit cardiac de 3,5 L/min/m2, suprafață
corporală 0,25 m2, FR 45/min)
Transferul de oxigen și dioxid de
carbon
• În condiții fiziologice, O2 este transferat la țesuturi aproape integral în
combinație cu hemoglobina (Hb) din eritrocite, doar 3% este dizolvat
în plasmă.
• 1 g Hb poate lega maxim 1,34 ml O2.
• Dar cantitatea de O2 care se leagă de Hb din eritrocite este direct
proporțională cu PO2 plasmatic și este cunoscută grafic drept curba
de disociere a Hb (Figura nr. 8).
• Hemoglobina fetală are afinitate mai mare pentru O2 față de cea de
adult și curba sa de disociere este deviată la stânga (saturații mai mari
la aceiași PaO2).
Transferul de oxigen și dioxid de
carbon
• Variați factori pot determina devierea
curbei de disociere a Hb
• Aspectul abrupt al curbei în porțiunea
inferioară sugerează că țesuturile
periferice primesc mai mult O2 la
scăderi mici ale PaO2 capilar
• Presiunea O2 în sângele capilar este
de circa 40 mmHg ceea ce corespunde
unei saturații în O2 de 75%
• Procentul de Hb legată de O2 este
exprimat ca saturație procentuală
(SaO2) și este egală cu conținutul de
O2 din sânge raportat la capacitatea de
transport a O2 de către Hb X 100, adică
SaO2 (%) = conț. O2/cap. O2 X 100
Transferul de oxigen și dioxid de
carbon
• Transportul CO2 în sânge nu e la fel de complex ca cel al O2, CO2 se
află în sânge ca gaz liber în soluție (este de 20 de ori mai solubil în
plasmă față de O2) sau în combinații chimice cu Hb și proteinele
plasmatice dar mai ales sub formă de ioni bicarbonat (70-90%).
• CO2 se combină cu apa pentru a forma acid carbonic care disociază
ulterior în ioni de hidrogen și de bicarbonat.
• Unii ioni de oxigen se combină cu apa și formează H+Hb + O2.
• Forma redusă a Hb este mai acidă și acceptă ionii de H ceea ce face
ca o cantitate mai mare de CO2 să fie transportată în sângele venos
sub formă de ioni de bicarbonat, facilitând preluarea tisulară a CO2
• Reacția inversă facilitează eliberarea de CO2 la nivelul capilarelor
pulmonare pentru a fi înlăturat prin ventilație.
Transferul de oxigen și dioxid de
carbon
• Starea acido-bazică a sângelui (pH-ul) este rezultatul raportului dintre
concentrația de bicarbonat și CO2 în soluție; acest raport este, în
condiții normale, de 20 și la această valoare pH-ul este stabil la 7,4.
• Cantitatea de bicarbonat din sânge este determinată în principal de
rinichi și de PCO2 din plămâni
– creșterea bicarbonatului duce la scăderea pH-ului (acidoză respiratorie) iar rinichii
elimină o urină mai acidă (secretă oni negativi și reabsoarbe ionii de bicarbonat) dar
compensarea renală este foarte greoaie (nu se obține, de fapt, aproape niciodată).
– scăderea PCO2 duce rapid la creșterea pH-ului (alcaloză respiratorie) și
compensarea renală se produce prin eliminarea ubnei cantități mai mari de
bicarbonat
– în acidoza și alcaloza metabolică compensarea respiratorie constă în hiper-,
respectiv hipoventilație pentru menținerea pH-ului fiziologic.
• Curba de disociere a CO2 este mai abruptă decât cea a O2 ceea ce
înseamnă că variația conținutului în CO2 din sânge este mai mare la
variații ale presiunii parțiale ale CO2
Situații anormale
Hipoventilația
• Hipoventilația - înlăturarea inadecvată a CO2 comparativ cu producția
de CO2 ceea ce va duce valorile gazului alveolar, treptat, spre cele ale
sângelui venos; PaO2 poate fi crescut ușor prin creșterea FiO2 iar
acumularea de CO2 poate fi corectată prin creșterea FR și/sau a VT
dar aceasta poate necesita o perioadă de timp (CO2 este stocat în
mare parte sub formă de bicarbonat)
• Principalele cauze de hipoventilație sunt:
- crizele de apneea ale prematurului
- deprimarea SNC (anestezice, medicamente)
- afecțiuni ale SNC
- boli care afectează mușchii respiratori (paralizia de diafragm, musculatura slabă
respiratorie a prematurilor, etc.)
- obstrucții ale CRS (atrezia coanală, sd. Pierre-Robin, laringomalacie, etc)
- obstrucții sau poziționarea incorectă a sondei de intubație
- oboseală extremă în afecțiuni pulmonare care necesită efort respirator marcat.
Situații anormale
Difuziune anormală
• Plămânii normali au posibilități serioase
de asigurare a difuziunii O2
• În anumite situații patologice – edem
pulmonar, fibroză interstițială –
difuziunea O2 este încetinită ceea ce
duce la alterări ale raportului
ventilație/perfuzie și hipoxie secundară
• Hipoxia poate fi înlăturată rapid prin
administrare de O2 iar creșterea PO2 la
nivel alveolar ajută la ameliorarea
difuziunii
• CO2 difuzează foarte rapid așa încât,
practic, nu există dificultăți de difuziune a
CO2
Situații anormale
Shunt-uri extrapulmonare
• Termenul de shunt extrapulmonar = trecerea sângelui din partea dreaptă a
inimii în cea stângă fără a trece prin ariile pulmonare ventilate
• PaO2 scade datorită amestecului sângelui oxigenat cu cel ne-oxigenat
• Când FiO2 crește peste 30% administrarea de O2 nu mai poate corecta
hipoxemia și permite diferențierea shunt-urilor extrapulmonare de alte cauze
de hipoxie
• În hipoxemia de alte cauze – hipoventilație, afectarea difuziei, alterarea
raportului ventilație/perfuzie – administrarea de O2 100% duce la creșterea
PaO2 aproape la valori normale
• PaCO2 nu este afectat în cazul aceste shunt-uripentru că hipoxia și
hipercapnia din sângele neoxigenat determină creșterea ventilației alveolare și
scăderea PaCO2
• Pot determina probleme de ventilație în multe din afecțiunile neonatale; în
aceste situații administrarea de oxigen este elementul critic pentru reducerea
RVP și diminuarea shunt-ului.
Situații anormale
Alterări ale raportului ventilație/perfuzie (VA/Q)
• cea mai frecventă cauză a anomaliilor schimburilor de O2 în
afecțiunile pulmonare, rareori determină alterări ale schimburilor de
CO2
• produc rareori hipercapnie pentru că chemoreceptorii au eficiență
deosebită în menținerea constantă a CO2 arterial prin creșterea
ventilației
• și în plămânul normal există variații ale raportului VA/Q dar cu efect
neglijabil asupra schimburilor totale de gaze
• distribuția ventilației este dependentă mai ales de complianța tisulară
și de rezistența căilor aeriene.
Situații anormale
Alterări ale raportului ventilație/perfuzie (VA/Q)
• când raportul VA/Q este zero, alveolele sunt neventilate dar perfuzate
(efect de shunt), nu există schimb de gaze, se stabilește un echilibru
între sângele venos și aerul din alveolele neventilate – shunt
intrapulmonar: sângele care perfuzează zonele neventilate nu este
oxigenat și nici CO2 nu este eliminat iar consecințele sunt identice cu
cele ale shunt-ului extrapulmonar
– intervine compensator vasoconstricția hipoxică a capilarelor care perfuzează arii
neventilate și sângele local este deviat spre alveole ventilate
– dacă ocluzia vaselor de sânge persistă alveolele vor colaba și atelectazia se
produce mai rapid dacă pacientul primește concentrații mari de O2
– azotul are o solubilitate mai mică și prezența sa întârzie colapsul alveolar secundar
obstrucției
– dependența de oxigen – caracteristică prematurilor cu displazie bronho-pulmonară
– se datorează aproape cu certitudine prezenței unor multiple shunt-uri cu raport
VA/Q redus.
Situații anormale
Alterări ale raportului ventilație/perfuzie (VA/Q)
• Când VA/Q = infinit:
– alveolele sunt ventilate dar neperfuzate (efect de spațiu mort)
– schimburile de gaze nu se produc
– aerul din alveole are aceleași presiuni parțiale ca și aerul
atmosferic
– O2 nu este transferat în sânge și CO2 nu este eliminat
– treptat va crește spațiul mort respirator ceea ce duce la reducerea
ventilației alveolare și, progresiv, la reducerea perfuziei.
Situații anormale
Hipoxia din anemie și hipoperfuzie
• Pentru a asigura aportul adecvat de O2 la țesuturi este necesară o
concentrație de Hb normală și un debit cardiac adecvat
– eficacitatea QC se verifică prin evaluarea culorii și temperaturii pielii, a pulsurilor
periferice, a valorilor gazelor sangvine, diurezei și, indirect, prin ecocardiografie
Doppler color
– scăderea Hb duce la scăderea conținutului sângelui în O2 fără variații ale PaO2.
• Cel mai tipic exemplu de insuficiență respiratorie în neonatologie este
SDRDS în care deficitul de surfactant și alterările complianței
pulmonare duc la atelectazie și distribuție anormală a ventilației,
edemul și exsudatul din alveole pot afecta difuziunea O2 iar rezultatul
este hipoxie care, combinată cu acidoza, agravează situația prin
creșterea rezistențelor vasculare pulmonare și formarea de shunt-uri
și hipoperfuzie pulmonară. Mai departe, efortul respirator crescut
poate duce la apariția hipoventilației după faza inițială caracterizată de
tahipnee.
Mulțumesc pentru atenție!
S-ar putea să vă placă și
- BronhopneumonieDocument73 paginiBronhopneumonieParfene Vlad100% (10)
- Dezvoltarea Sistemului RespiratorDocument34 paginiDezvoltarea Sistemului RespiratorTeofil100% (2)
- Dezvoltarea Sistemului RespiratorDocument25 paginiDezvoltarea Sistemului RespiratorAna-Maria BuneaÎncă nu există evaluări
- Formarea Si Dezvoltarea Aparatului Respirator La Embrionul UmanDocument3 paginiFormarea Si Dezvoltarea Aparatului Respirator La Embrionul UmanMarin ClaudiuÎncă nu există evaluări
- Lucrare de StagiuDocument25 paginiLucrare de Stagiutoma100% (1)
- Particularitatile Anatomo Fiziologice Ale Sistemului RespiratorDocument2 paginiParticularitatile Anatomo Fiziologice Ale Sistemului RespiratorVero Veronica0% (1)
- Lucrare de Diploma CorinaDocument81 paginiLucrare de Diploma CorinaMiha Miha100% (2)
- Inrijirea Bolnavului Cu Pneumonie Acute BacerianaDocument86 paginiInrijirea Bolnavului Cu Pneumonie Acute BacerianaMuntean Maria83% (6)
- Dieta pentru zile senine II: De la durere la echilibru spiritual, psihologic, nutritivDe la EverandDieta pentru zile senine II: De la durere la echilibru spiritual, psihologic, nutritivEvaluare: 5 din 5 stele5/5 (1)
- Curs 1 - Dezvoltarea Aparatului RespiratorDocument9 paginiCurs 1 - Dezvoltarea Aparatului RespiratorMihaela VulkÎncă nu există evaluări
- Anatomia funcțională a sistemului respirator - копияDocument32 paginiAnatomia funcțională a sistemului respirator - копияcostin dÎncă nu există evaluări
- Dezvoltare Embriologica PlamanDocument3 paginiDezvoltare Embriologica PlamanGeorge CatalinÎncă nu există evaluări
- Septarea Ventriculului PrimitivDocument5 paginiSeptarea Ventriculului PrimitivVioleta NitaÎncă nu există evaluări
- Afectiuni Bronsice FinalDocument135 paginiAfectiuni Bronsice FinalDaniel BucurÎncă nu există evaluări
- Semiologia Aparatului Respirator La CopiiDocument61 paginiSemiologia Aparatului Respirator La CopiiIoana PascaÎncă nu există evaluări
- Proiect Pentru LicientaDocument33 paginiProiect Pentru LicientaAndreea Gabriela100% (1)
- Licenta PneumonieDocument27 paginiLicenta PneumonieAlin BratuÎncă nu există evaluări
- 4.PAF Ale Sistemului RespiratorDocument56 pagini4.PAF Ale Sistemului RespiratorAlina VechiuÎncă nu există evaluări
- PULMONOLOGia PedDocument167 paginiPULMONOLOGia PedARINA GAINAÎncă nu există evaluări
- Curs 2Document22 paginiCurs 2Malina IoanaÎncă nu există evaluări
- Viroza Respiratorie 2016Document70 paginiViroza Respiratorie 2016Prisăcaru Ionel Viorel100% (5)
- Lucrare Practica PediatrieDocument51 paginiLucrare Practica PediatrieKorodi MelindaÎncă nu există evaluări
- Curs 1 RO-dezv Ap RespiratorDocument43 paginiCurs 1 RO-dezv Ap RespiratorVASILICA-ALEXANDRA GAVRILESCUÎncă nu există evaluări
- Dezvoltarea Sistemului RespiratorDocument3 paginiDezvoltarea Sistemului RespiratorOan 'CeaÎncă nu există evaluări
- Arborele Traheo-BronsicDocument24 paginiArborele Traheo-BronsicAna-Maria ChiriacÎncă nu există evaluări
- Pneumologie Si Nursing SpecificDocument37 paginiPneumologie Si Nursing SpecificEne ElenaÎncă nu există evaluări
- Sist Respirat 20-21-1Document8 paginiSist Respirat 20-21-1Alexandru HoagheaÎncă nu există evaluări
- Curs 1Document29 paginiCurs 1oanaÎncă nu există evaluări
- BronhopneumonieDocument59 paginiBronhopneumonieMarius Adrian Birca100% (1)
- Curs 1Document52 paginiCurs 1Ovidiu MarianÎncă nu există evaluări
- Anatomie Curs IDocument5 paginiAnatomie Curs ISabina CiubotariuÎncă nu există evaluări
- LARINGOLOGIADocument15 paginiLARINGOLOGIAdorimena13Încă nu există evaluări
- Fiziologia FetalaDocument41 paginiFiziologia FetalaMia MadalinaÎncă nu există evaluări
- Rinologie - PPT CorectatDocument317 paginiRinologie - PPT CorectatDani SirbuÎncă nu există evaluări
- Ped Subiecte RezDocument32 paginiPed Subiecte RezalinaÎncă nu există evaluări
- PlamaniDocument1 paginăPlamaniDelia IchimescuÎncă nu există evaluări
- Pneumologie Anatomie - Curs 1 NursingDocument45 paginiPneumologie Anatomie - Curs 1 Nursingblume_weiss7651100% (2)
- Cazul PneumoniiDocument75 paginiCazul PneumoniiSmadu Adriana50% (2)
- Anatomie ComprimatDocument59 paginiAnatomie ComprimatOtiliaMariaÎncă nu există evaluări
- Aparatul Respirator - Suport de CursDocument14 paginiAparatul Respirator - Suport de CursAlex Dițoiu0% (1)
- Ingrijirea CopiluluiDocument86 paginiIngrijirea CopiluluiAdrian TKaÎncă nu există evaluări
- UntitleddddDocument35 paginiUntitleddddCristian GrecuÎncă nu există evaluări
- Manual de Pneumologie ClinicaDocument179 paginiManual de Pneumologie ClinicaDolhascu Diana100% (5)
- Ingrijirea Copilului Cu Patologie RespiratorieDocument71 paginiIngrijirea Copilului Cu Patologie RespiratorieRadu ScarlatÎncă nu există evaluări
- TBC PulmonarDocument101 paginiTBC PulmonarAnonymous b8pnWJMÎncă nu există evaluări
- Pediatrie An 3Document39 paginiPediatrie An 3Alexandra GheorghicaÎncă nu există evaluări
- Fit Generation: Primul Manual De Fitness Din RomaniaDe la EverandFit Generation: Primul Manual De Fitness Din RomaniaEvaluare: 4 din 5 stele4/5 (8)
- File alese din istoria cardiologiei romanestiDe la EverandFile alese din istoria cardiologiei romanestiÎncă nu există evaluări
- Iluzie sau realitate? (Reflecții și fantezii despre misterul vieții și comunicarea temporală)De la EverandIluzie sau realitate? (Reflecții și fantezii despre misterul vieții și comunicarea temporală)Evaluare: 3.5 din 5 stele3.5/5 (2)
- O zi din viața creierului: O perspectivă a neuroștiințeiDe la EverandO zi din viața creierului: O perspectivă a neuroștiințeiÎncă nu există evaluări