Documente Academic
Documente Profesional
Documente Cultură
Leucemia Mielomonocitara Cronica LMMC
Încărcat de
Rosca GabrielaTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Leucemia Mielomonocitara Cronica LMMC
Încărcat de
Rosca GabrielaDrepturi de autor:
Formate disponibile
ANEXA NR.
17
LEUCEMIA MIELOMONOCITARA CRONICA (LMMC)
LMMC este o boala rară a cărei incidenţă este de 3 cazuri/100.000/an în populaţia de peste 60 ani, cu o incidenţă
pe sexe de 2 :1 (b :f). Mediana vârstei la diagnostic este de 65-75 ani. O proportie de 15-20% din cazuri se
transforma in Leucemie acută mieloblastică.
Boala are atat trăsături mieloproliferatve cât şi mielodisplazice astfel că, în 1994, grupul FAB a propus o
separare a cazurilor de LMMC într-o formă mieloproliferativă (LMMC-MP) cu leucocite peste 13.000/mmc, şi
o formă displazică (LMMC-MD) cu leucocite sub 13.000/mmc. Clasificarea OMS din 2016 reintroduce LMMC
intr-un grup comun de neoplazii mieloproliferative/mielodisplazice şi împarte LMMC în trei grupe bazate pe
numărul de blaşti:
LMMC-0: < 2 % blaşti (inclusiv promonocite) în sângele periferic si < 5 % blaşti (inclusiv promonocite)
în măduva osoasă,
LMMC-1: 2-4 % blaşti (inclusiv promonocite) în sângele periferic and 5-9 % blaşti (inclusiv
promonocite) în măduva osoasă,
LMMC-2: 5-19 % blaşti (inclusiv promonocite) în sângele periferic and 10-19 % blaşti (inclusiv
promonocite) în măduva osoasă.
Tabel – Clasificarea OMS 2016 a bolilor mieloproliferative/mielodisplazice
Neoplazii mieloproliferative/mielodisplazice (MDS/MPN)
Leucemia mielomonocitara cronica (LMMC)
Leucemia mieloida cronica atipica (aCML), BCR-ABL1-
Leucemia mielomonocitara juvenila (JMML)
MDS/MPN cu cidroblasti in inel si trombocitoza (MDS/MPN-RS-T)
MDS/MPN, neclasificabile
Tabel – Criterii de diagnostic pentru LMMC
Criterii de diagnostic ale LMMC
• Monocitoza persistenta in sangele periferic > 1000/mmc reprezentand 10% din leucocite
• Nu intruneste criteriile OMS pentru LMC BCR-ABL1+ , MFP, PV, sau ET*
• Nu prezinta rearanjamente in PDGFRA, PDGFRB, sau FGFR1 sau PCM1-JAK2 (trebuie excluse in caz de eosinofilie)
• < 20% blaşti ian sangele periferic si BM †
• Displazie în una sau mai multe linii mieloide. Daca displazia este absenta sau minima diagnosticul poate fi facut daca celelalte cerinte
sunt indeplinite si
• O anomalie citogeneti a sau moleculara dobandita este prezenta in cellule hematopoietice sau
• Monocitoza persista de cel putin 3 luni si
• Alte cauze de monocitoza au fost excluse
Monocitoză peste 1000/mmc cu
monalite > 10% din leucocite
persistenta de peste 3 luni
Asociată cu alte anomalii în sângele periferic
SAU istoric anterior de malignitate hematologică SAU sistemică anteriPDGRFA sau
PDGRFBoară la chimioterapie / expunere la radiații ionizante
Da Nu
BOM pentru confirmare LMMC Excludere boală infectţioasă sau
sau altă boală medulară process autoimun
Evaluare pentru BCR-ABL sau FISH pentru
rearanjari in PDGFRA sau PDGFRB
BOM
LMMC Alt neoplasm myeloid sau
peste 20% blasti
<2% blaşti periferici şi 2-4% blaşti periferici şi 5- >5% blaşti periferici şi
<5% blasti medulari 9% blasti medulari 10-19% blasti medulari
LMMC-0 LMMC-1 LMMC-2
Boala In sange In maduva
Monocitoză > 1.000/mmc Displazie in una sau mai multe linii
Leucemie mielomonocitara Nu intruneste criteriile OMS pentru LMC Ph1+, mielofibroza mieloide1
cronica (LMMC) primara (MFP), policitemie vera (PV) sau trombocitemie
esentiala1 < 20 % basti2
Fara rearanjamente gene PDGFRA, PDGFRB or FGFR1
< 20 % blasti 2
Daca mielodisplazia este absenta sau minima, diagnosticul de
LMMC poate fi stabilit daca celellte criterii sint indeplinite si
o anomalie citogenetica sau moleculara clonala dobandita
este prezenta in celula hematopoietica3 SAU monocitoza
persista el putin 3 luni si celelalte cauze de monocitoza au fost
excluse
Leucocitoza, neutrofilie MO hipercelulara cu proliferare
Leucemie mieloida cronica Displazie neutrofilica granulocitara si diplazie granulocitara
atipica, BCR-ABL1 negativa Neutrofilele si precursorii lor³10 % din leucocite cu sau fara displazie pe celelalte linii
(LMCa) Absenta genei de fuziune BCR-ABL1
Absenta rearanjamente PDGFRA, PDGFRB or FGFR1 sau < 20 % blasti in sange si MO
PCM1-JAK2 (trebuie exclusa in cazurile cu eozinofilie)
Bazofilie absenta sau minima
monocite < 10% din leucocite
nu intruneste criteriile OMS pentru MFP, PRV, TE4
I. criterii clinic si de laborator (toate 4 sunt obligatorii). <20% blasti.
Leucemia mielomonocitara Monocite sanguine >1.000/mmc, blasti in sange si maduva
juvenila (LMJ) <20%, splenomegalie, absenta crs Philadelphia rearanjament Argumente de clonalitate
(BCR/ABL1.
II. Studii genetice (o anomalie este suficienta). Mutatii
somatice in PTPN11 sau KRAS sau NRAS (mutatii gemline
(indicaand sdr Noonan) trebuie excluse) diagnostic clinic
NF1 sau mutatii NF1, mutatii germline CBL si pierderea
hererozigozitatii CBL.
III. pentru pacientii fara anomalii genetice, alaturi de criteriile
de la I, urmatoarele criterii trebuie indeplinite: Monosomie 7
sau oricare alte anomalii crs sau cel putin 2 din criteriile:
Hemoglobina F crescuta pentru varsta, precursori mieloizi
sau eritroizi in sangele periferic, hipersensibilitate la GM-
CSF in culturi, hiperfosforilare STAT
Anemie < 1 % blasti in sange si < 5 % blasti in
Neoplazie mielodisplazica/ Trombocitoza persistenta > 450.000/mmc MO
mieloproliferativa cu Prezenta mutatii in SF3B1 sau, in absenta lor, fara istoric de
sideroblasti in inel si tratament cytotoxic sau cu factori de crestere c ear putea Diseritropoieza in MO cu sideroblasti
trombocitoza explica anomaliile displazice/proliferative6. Far gena de in inel >15% dinprecursori eritroizi5.
fuziune BCR-ABL1, fara rearanjamente in PDGFRA, Megacariocite anormale sunt
(MDS/MPN-RS-T) PDGFRB sau FGFR1; sau PCM1-JAK2; fara semnalate in MFP sau TE
t(3;3)(q21;q26),inv(3)(q21q26) or del(5q) 7
fara antecedente de MPN, MDS (except MDS-RS), sau alt tip
de MDS/MPN
Amestec de caracteristici SMD si SMP Trasaturi amestecate de SMD si SMP
Neoplasm Fara diagnostic anterior de SMP sau SMD
mielodisplazic/mieloprolifer Fara istoric recent de terapie citotoxica sau factori de crestere <20% blasi
ativ neclasificabil
(MDS/MPN) Fara gena de fuziune BCR-ABL1 fsau rearanjamente
PDGFRA or PDGFRB
1. Cazurile de NMP pot fi asociate cu monocitoza sau pot dezvolta o monocitoza in evolutie. Aceste cazuri pot simula o LMMC. In
aceste cazuri rare un istoric de boala mieloproliferativa documentata poate exclude LMMC, in timp ce prezenta de anomalii specific
NMP in maduva si/sau de NMP cu mutatii asociate (JAK2, CALR sau MPL) tind sa sustina o mieloproliferare cu monocitoza decat o
LMMC.
2. blastii si echivalentii include mieloblasti, monoblasti si promonocite. Promonocitele sunt precursori monocitici cu citoplasma
abundenta, gri sau usor basofilica si cateve granulatii mov, fin raspandite, nuclei cu cu cromatina laxa, nucleoli proeminenti si
plicaturare nucleara. Monocite anormale, care pot fi prezente in sangele periferic sic el medular sunt excluse din numaratoarea blastilor.
3. Prezenta de mutatii in gene adesea associate cu LMMC (ex. TET2, SRSF2, ASXL1, SETBP1) in context clinic corespunzator pot fi
utilizate in sustinerea diagnosticului. Trebuie notat, totusi, ca multe din aceste mutetii pot fi legate de varsta sau pot fi prezente in
subclone.. Deci precautie in interpretarea rezultatelor genetice.
4. Cazurile de neoplasme myeloproliferative (NMP), mai ales cele in faza accelerate si/sau cu mielofibroza post-policitemie sau post-
trombocitemie, daca sunt neutrofilici pot simula o LMC accelerata. Un istoric de NMP, prezenta de modificari NMP in maduva si/sau
mutatii associate NMP (in JAK2, CALR or MPL) tind sa excluda diagnosticul de aCML. Dimpotriva, diagnosticul de aCML este
sustinut de prezenta mutatiilor in SETBP1 si/sau ETNK1. Prezenta mutatiei CSF3R este smnalata in aCML si daca este detectata trebuie
sa determine o revedere morfologica atenta pentru a exclude un diagnostic alternative de leucemie cronica cu neutrofile sau alt
neoplasm mieloid.
5. 15% sideroblasti in inel sunt necesarari chiar daca mutatia SF3B1 este detectata.
6. un diagnostic de MDS/MPN-RS-T este sustinut de prezenta mutatiei SF3B1 impreuna cu o mutatie in genele JAK2 V617F, CALR
sau MPL.
7. In in care se indeplinesc criteriile de diagnostic pentru SMD cu del(5q)- fara sau cu basofilie minima; basofilele sunt deobicei < 2%
din leucocite.
PROGNOSTICUL IN LMMC
Au fost propuse diferite scoruri prognostice, Scorul IPSS utilizat in sindroamele mielodisplazice nu include si
cazurile de LMMC cu leucocitoza peste 12.000/mmc.
Astfel, a fost creat un system de scor specific pentru LMMC (CPSS), vezi table. Acest system defineste
4 categorii de factori prognostici important precum subtipul OMS, subtipul FAB, categoriile de risc genetic
specific si dependenta transfuzionala. Pacientii sunt impartiti In 4 categorii de risc cu supravietuire globala si
transformare in LAM diferite.
Tabel – scorul CPSS
Variabila Punctaj
0 1 2
Blaşti (%) <10 % in MO si < 5 % in SP 10-19 % in MO sau 5-19 % in SP
Nr Leucocite < 13.000/mmc > 13.000/mmc
Kariotip° Risc scazut Risc intermediar Risc inalt
Dependenta Nu Da
transfuzionala
Tabel – scorul genetic al LMMC si scorul CPSS molecular
Grupul de ASXL1 NRAS RUNX1 SETBP1
risc
citogenetic
Variabila
0 Scazut Nemutat Nemutat Nemutat Nemutat
1 Intermediar Mutat Mutat NA Mutat
2 Inalt NA NA Mutat NA
Grupul de risc Scor
genetic
Scazut 0
Intermediar – 1 1
Intermediar - 2 2
Inalt ≥3
Grupurile de risc citogenetic sund deficniyte potrivit lui Such si col : scazut, normal, si –Y izolat; intermediar,
alte anomalii; inalt, trisomie 8, cariotip complex (≥3 anomalii), si anomalii ale crs 7.
Grupul de risc Blasti Numar Dependenta de transfuzii eritrocitare
genetic medulari Leucocite
Variabila
0 Scazut < 5% < 13.000/mmc Nu
1 Intermediar - 1 ≥ 5% ≥ 13.000/mmc DA
2 Intermediar - 2 NA NA NA
3 Inalt NA NA NA
Grupul de risc genetic Scor
Scazut 0
Intermediar – 1 1
Intermediar - 2 2
Inalt ≥3
TRATAMENTUL LMMC
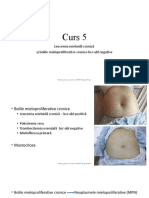
Indicaţiile terapeutice în LMMC sunt reprezentate de febră, scădere ponderală, citopenii, splenomegalie
simptomatică, progresia bolii cu cresterea procentului de blaşti, hipertrofie gingivală, infiltrare leucemică
cutanată, semne de CIVD.
Hidroxiurea rămâne terapia principală pentru pacienții cu caracteristici mieloproliferative.
Nu există ghiduri specifice pentru terapia de susținere precum utilizarea analogilor de eritropoietină pentru
tratamentul anemiei, antibioterapia profilactică pentru neutropenia izolată sau terapia chelatoare de fier
pentru pacienții cu o încărcare transfuzională mare. Aceste măsuri de îngrijire sunt, în general, similare
cu cele utilizate la pacienții cu SMD.
Agenţii hipometilanţi rămân singurele medicamente aprobate pentru gestionarea LMMC și sunt asociate
cu rată globală a răspunsurilor de 40% -50% și rate ale răspunsuloi complet de < 20%. Factorii predictivi
ai răspunsului la agenţii hipometilanţ rămân neprecizaţi, cu câteva sugestii precum genotipul ASXL1WT
/ TET2MT ar putea fi predictiv.
Allotransplantul de celule stem hematopoietice este singura opţiune curativă dar procedura se aplică
numai unei minorități afectate şi asociază o rată crescută de morbiditate și mortalitate.
Definirea criteriilor de răspuns specifice LMMC este un pas major și date răspunsurile slabe la terapiile
disponibile în prezent, înscrierea în studiile clinice specifice CMML ar trebui încurajată puternic.
Atitudine terapeutică:
De luat în considerare allotransplantul de celule stem în LMMC-1 şi LMMC-2.
Pacienţii cu LMMC-2 (10-19% blaşti şi promonocite în măduva osoasă) şi leucocitoză sub 13.000/mmc
Azacitidina.
Pacienţii cu LMMC-2 (10-19% blaşti şi promonocite în măduva osoasă) şi leucocitoză peste 13.000/mmc
dar fără creşteri majore : Azacitidina, Hydroxiuree sau chimioterapie LAM-like.
Pacienţii cu LMMC-1 (5-9% blaşti şi promonocite în măduva osoasă) si leucocitoza sub 13.000/mmc si
factori citogenetici cu risc crescut : Azacitidina daca este candidat pentru allotransplant. Altfel poate
astepta, eventual EPO.
Pacientii cu LMMC-0 (< 5 % blasti) sau LMMC-1 (5-9 % blasti si promonocite in maduva osoasa) si
leucocite peste 13.000/mmc: Hydroxyurea daca este simptomatic, si EPO daca este anemic.
Bibliografie:
1. Myelodysplastic syndromes: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up P. Fenaux D. Haase G.
F. Sanz V. Santini C. Buske .Annals of Oncology, Volume 25, Issue suppl_3, 1 September 2014, Pages iii57–iii6
2. Diagnosis and treatment of primary myelodysplastic syndromes in adults: recommendations from the European
LeukemiaNet. Luca Malcovati, Eva Hellström-Lindberg David Bowen, Lionel Adès et al.
3. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Daniel A. Arber,
Attilio Orazi, Robert Hasserjian, J¨urgen Thiele, Michael J. Borowitz, Michelle M. Le Beau, Clara D. Bloomfield, Mario Cazzola, and
James W. Vardiman. Blood. 2016; 127(20):2391-2405
4. Myelodysplastic Syndromes, Version 2.2017 . Clinical Practice Guidelines in Oncology
Peter L. Greenberg, MD; Richard M. Stone, MD; Aref Al-Kali, MD; Stefan K. Barta, MD, MS, MRCP; Rafael Bejar, MD, PhD; John
M. Bennett, MD; Hetty Carraway, MD, MBA; Carlos M. De Castro, MD; H. Joachim Deeg, MD; Amy E. DeZern, MD, MHS; Amir
T. Fathi, MD; Olga Frankfurt, MD; Karin Gaensler, MD; Guillermo Garcia-Manero, MD; Elizabeth A. Griffiths, MD; David Head,
MD; Ruth Horsfall, PhD; Robert A. Johnson, MD; Mark Juckett, MD; Virginia M. Klimek, MD; Rami Komrokji, MD; Lisa A.
Kujawski, MD; Lori J. Maness, MD; Journal of the National Comprehensive Cancer Network |Volume 15Num be r 1 |Jan uary 20017
5. What is New in the 2016 Revision to WHO Classification of Myelodysplastic Syndromes?. Nahla A M H Canc Therapy & Oncol
Int J. 2017; 4(4): 555645.
6. Myelodysplastic syndromes current treatment algorithm 2018. David P. Steensma. Blood Cancer Journal (2018) 8:47
7. Myelodysplastic syndromes: 2018 update on diagnosis, risk‐stratification and management, Guillermo Montalban‐Bravo, Guillermo
Garcia‐Manero. Am J Hematol. 2018 Jan;93(1):129-147
8. Guidelines for the diagnosis and treatment of Myelodysplastic Syndrome and Chronic Myelomonocytic Leukemia. Nordic MDS
Group. MDS and CMML Guidelines. 8th update, May 2017 Chronic Myelomonocytic leukemia: 2020 update on diagnosis, risk
stratification and management Chronic Myelomonocytic leukemia: 2020 update on diagnosis
9. Chronic Myelomonocytic leukemia : 2020 update on diagnosis, risk stratification and management. Mrinal M Patnaik, Ayalev
Tefferi. Am J Hematol. 2020; 95:97-115
S-ar putea să vă placă și
- C3 - Clasificarea Şi DG Leucemiilor AcuteDocument42 paginiC3 - Clasificarea Şi DG Leucemiilor AcuteMarius - Adrian DraganÎncă nu există evaluări
- Mielofibroza PrimarăDocument8 paginiMielofibroza PrimarăAdina StemateÎncă nu există evaluări
- SMDDocument29 paginiSMDBisa2000Încă nu există evaluări
- DG NMP BCR-ABL1 Negative Oct. 2021Document31 paginiDG NMP BCR-ABL1 Negative Oct. 2021drumdramÎncă nu există evaluări
- Leucemiile Acute2020Document77 paginiLeucemiile Acute2020lalunalalunaÎncă nu există evaluări
- Curs3 Hematologie Anv seriaCD LADocument76 paginiCurs3 Hematologie Anv seriaCD LAZitawi Anas100% (1)
- Hematologie CursDocument81 paginiHematologie CursRaluca PăunaÎncă nu există evaluări
- LGCDocument45 paginiLGCCristina Buzatu100% (1)
- CA - Curs LAM Nov. 15 2005Document64 paginiCA - Curs LAM Nov. 15 2005Georgiana PÎncă nu există evaluări
- LLCDocument59 paginiLLCLarisa StefanÎncă nu există evaluări
- MSD - Curs HEMA RDocument13 paginiMSD - Curs HEMA RDunca Ana-MariaÎncă nu există evaluări
- Leucemii 3Document2 paginiLeucemii 3stefÎncă nu există evaluări
- Document From PetyDocument2 paginiDocument From Petycretuolgutza91Încă nu există evaluări
- HematologieDocument3 paginiHematologievalentyÎncă nu există evaluări
- DG NMP BCR-ABL1 NegativeDocument37 paginiDG NMP BCR-ABL1 NegativeSilvia CarsteaÎncă nu există evaluări
- Leucemia Acuta Mieloblastica (LAM)Document4 paginiLeucemia Acuta Mieloblastica (LAM)Livia GrigoreÎncă nu există evaluări
- Leucemii CursDocument87 paginiLeucemii CursAdriana PavalacheÎncă nu există evaluări
- 2012 Sindroame Mieloproliferative CroniceDocument67 pagini2012 Sindroame Mieloproliferative CroniceDiana MincuÎncă nu există evaluări
- HEMATO Curs 5Document10 paginiHEMATO Curs 5Alex OlahÎncă nu există evaluări
- Leucemia Mieloidă CronicăDocument34 paginiLeucemia Mieloidă CronicăGumus MedelaineÎncă nu există evaluări
- Boli MieloproliferativeDocument148 paginiBoli MieloproliferativeAlina MadalinaÎncă nu există evaluări
- Curs 3 - Leucemii AcuteDocument30 paginiCurs 3 - Leucemii AcuteOana ChibulcuteanÎncă nu există evaluări
- LMCDocument6 paginiLMCMaria RamosÎncă nu există evaluări
- 5.leucemia Mieloida CronicaDocument45 pagini5.leucemia Mieloida CronicaAlexandra MÎncă nu există evaluări
- DasatinibDocument13 paginiDasatinibAndreea NanuÎncă nu există evaluări
- Hematologie ClinicaDocument49 paginiHematologie ClinicaOctavian Iancu100% (13)
- Hemato Curs 5-2018Document52 paginiHemato Curs 5-2018Diana DÎncă nu există evaluări
- 4 Leucemiile AcuteDocument16 pagini4 Leucemiile AcuteAlina CiurciÎncă nu există evaluări
- 1-Leucemiile AcuteDocument20 pagini1-Leucemiile AcuteCătălina BlajinÎncă nu există evaluări
- Mielomul MultipluDocument13 paginiMielomul MultipluAlex UngureanuÎncă nu există evaluări
- Boli Mieloproliferative CroniceDocument56 paginiBoli Mieloproliferative CroniceAdina Varzaru100% (4)
- Dg. LMC. Neoplasme MieloproliferativeDocument29 paginiDg. LMC. Neoplasme MieloproliferativedrumdramÎncă nu există evaluări
- Metaplazia Mieloida Cu MielofibrozaDocument3 paginiMetaplazia Mieloida Cu MielofibrozaGenghiz Mustafa100% (2)
- Curs II. SDR MieloproliferativeDocument29 paginiCurs II. SDR MieloproliferativeLeon Bogdan GrecoÎncă nu există evaluări
- 1.LMC - CursDocument10 pagini1.LMC - Cursbriana13Încă nu există evaluări
- Fenes-Elena MielomulDocument29 paginiFenes-Elena MielomulTrauma got me sickÎncă nu există evaluări
- Leucemii CroniceDocument21 paginiLeucemii Croniceniko55555Încă nu există evaluări
- SDR MieloproliferativeDocument41 paginiSDR MieloproliferativeStefanaÎncă nu există evaluări
- Cursul 9Document43 paginiCursul 9Ilona PavelÎncă nu există evaluări
- Sindroame Mieloproliferative CroniceDocument69 paginiSindroame Mieloproliferative CroniceMariaÎncă nu există evaluări
- Leucemia Cu Celule PăroaseDocument9 paginiLeucemia Cu Celule PăroaseAdina StemateÎncă nu există evaluări
- Leucemia Limfatica CronicaDocument12 paginiLeucemia Limfatica CronicaDana SemenÎncă nu există evaluări
- Leucemia Limfatica Cronica: PatogenicDocument11 paginiLeucemia Limfatica Cronica: PatogenicVlad BezărăuÎncă nu există evaluări
- Leucemii AcuteDocument35 paginiLeucemii AcuteRamona Ion100% (1)
- Leucemii AcuteDocument119 paginiLeucemii AcuteMaria MirabelaÎncă nu există evaluări
- HematoDocument245 paginiHematoDiana MitreaÎncă nu există evaluări
- Leucemia Granulocitară CronicăDocument2 paginiLeucemia Granulocitară CronicăGlogogeanu Cristina AndreeaÎncă nu există evaluări
- 73 Sindrom MielodisplazicDocument3 pagini73 Sindrom MielodisplazicobrejaÎncă nu există evaluări
- Mielom MultipluDocument29 paginiMielom MultipluAdina StemateÎncă nu există evaluări
- Leucemia Granulocitara CronicaDocument31 paginiLeucemia Granulocitara CronicaUngureanu AndreiÎncă nu există evaluări
- Curs 3 Leucemii AcuteDocument72 paginiCurs 3 Leucemii AcuteMaricela IvașcuÎncă nu există evaluări
- Curs 3Document5 paginiCurs 3oviÎncă nu există evaluări
- HEMATO Curs 4Document5 paginiHEMATO Curs 4Alex OlahÎncă nu există evaluări
- LMCDocument11 paginiLMCVlad BezărăuÎncă nu există evaluări
- 1.LGC - CursDocument13 pagini1.LGC - CursAnna BorsÎncă nu există evaluări
- Curs 5 Mieloproliferări Cronice LMC, PV, TE, MFDocument94 paginiCurs 5 Mieloproliferări Cronice LMC, PV, TE, MFDavid-Alexandru ŞpanÎncă nu există evaluări
- Curs 6. Leucemii AcuteDocument72 paginiCurs 6. Leucemii AcuteAlexandra93% (15)