Documente Academic
Documente Profesional
Documente Cultură
Biochimie Clinica
Biochimie Clinica
Încărcat de
agoston_cristina0 evaluări0% au considerat acest document util (0 voturi)
8 vizualizări21 paginiBiochimie clinica
I. Circuitul Fe in organism
II. Ciroza hepatica
III. Diabetul zaharat
iv. Boala ischimica a inimii
Drepturi de autor
© © All Rights Reserved
Formate disponibile
PDF, TXT sau citiți online pe Scribd
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentBiochimie clinica
I. Circuitul Fe in organism
II. Ciroza hepatica
III. Diabetul zaharat
iv. Boala ischimica a inimii
Drepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca PDF, TXT sau citiți online pe Scribd
0 evaluări0% au considerat acest document util (0 voturi)
8 vizualizări21 paginiBiochimie Clinica
Biochimie Clinica
Încărcat de
agoston_cristinaBiochimie clinica
I. Circuitul Fe in organism
II. Ciroza hepatica
III. Diabetul zaharat
iv. Boala ischimica a inimii
Drepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca PDF, TXT sau citiți online pe Scribd
Sunteți pe pagina 1din 21
I.
Circuitul Fe in organism
Fe din diet
enterocitele duodenale
legata la transferina)
este absorbit in
plasm (in stare
Trasferina transport Fe in principal la:
Maduva osoas: incorporare Fe in
Hb din precursorii eritroizi
Muchi: incorporare in mioglobina
Depozitarea Fe (feritina): in celulele
parenchimale ale ficatului i macrofagele din
sistemul reticulo-endotelial
Circuitul Fe: este modificat n stri patologice
caracterizate prin:
- lipsa/excesul de Fe
Apariia unor disfuncii la nivelul
stomacului reduce substanial cantitatea de
Fe absorbit
Absorbtia intestinala a Fe (v. Fig din slide 103)
1) Fe heminic este eliberat prin digestia proteolitic a
hemoglobinei i mioglobinei (din hran) n lumenul intestinului subire:
- Hemul este preluat intact prin endocitoz la nivelul
membranei apicale a celulei intestinale
- ajunge n endozomi/lizozomi
este clivat de ctre
hemoxigenaz n biliverdin i Fe2+
In celula epitelial intestinala:
- o parte din Fe absorbit este reinut prin legare la apoferitina
- o alt parte din Fe absorbit este transferat n patul capilar i captat
de transferin (Tf):
Eliberarea Fe din intestin n sange are loc la nivelul membranei
bazo-laterale a celulei intestinale i este mediat de:
- o feroxidaz transmembranar dependent de cupru
(hefestin) ce convertete Fe (II) la Fe (III), i o protein de transport a
Fe (feroportina 1 sau IREG1)
2) n procesul de absorbie intestinal a Fe neheminic (sruri de Fe
(II) i Fe (III) i complexe organice)
Fe3+ este redus la Fe2+ de ctre acidul ascorbic i
ferireductazele membranare apicale ce includ citocromul B duodenal
DcytB (duodenal cytochrome B)
Mediul acid din regiunea brush border a intestinului subire
(rezultat din activitatea pompei Na+/ H+) furnizeaz un gradient de
potenial electrochimic de H+ pentru a pune n micare transportul
Fe2+ prin transportorul de ioni metalici divaleni DMT1 (divalent metal
- ion transporter 1) n enterocit
DMT1 contribuie si la absorbtia altor ioni metalici importanti
(Mn2+)
Acest transportor este responsabil i pentru recuperarea Fe
din endozomi, n timpul asimilrii complexelor FeTf-TfR in celulele
precursoare eritroide i multe alte tipuri celulare
Absorbia intestinal a fierului
HO: hemoxigenaza
DcytB: citocromul B duodenal
DMT1: transportorul de ioni metalici divaleni 1
IREG1: feroportina 1
Fe2Tf: transferina diferic
Homeostazia sistemic a fierului
n ciuda fluxului mare de Fe prin compartimentul plasmatic,
concentraiile de Fe n plasma uman sunt meninute n mod normal
n domeniul 10-30 M
existena unui mecanism important de
meninere a homeostaziei Fe
Studii recente sugereaz implicarea centrala a hepcidinului
in homeostazia Fe
Hepcidinul
Forma sa bioactiva este o peptid cationic de 25 de aminoacizi
- sintetizat i secretat predominant de catre hepatocite
Indeplineste un rol esential in homeostazia Fe prin:
1. reglarea absorbtiei intestinale a Fe
2. eliberarea Fe din depozitele hepatice si din macrofage
Secreia sa este reglat de:
- depozitele de Fe din organism
- gradul de oxigenare a tesuturilor
- mediatori inflamatori (IL-6, -1 etc.)
Mecanismul de actiune al hepcidinului
Hepcidinul regleaza expresia feroportinei pe membrana bazolateral a
enterocitelor
In deficiena de Fe. Secreia hepcidinului este supresat i feroportina puternic
exprimat pe membrana bazolateral
Absorbia Fe n snge este maxim
In excesul de Fe. Ficatul secret hepcidinul, care interacioneaz cu moleculele de
feroportin din membrana bazolateral, determinnd endocitoza i degradarea
feroportinei cu depozitare de Fe n celule. Deci:
Exportul de Fe din enterocite in plasm este sczut
celulele acumuleaz Fe
Eventual, enterocitele pline cu Fe se vor desprinde din epiteliul intestinal i vor fi
antrenate n lumenul intestinului i eliminate prin scaun (scaune colorate brun)
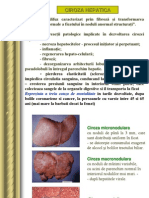
II. CIROZA HEPATIC
= condiie patologic n care ficatul rspunde la vtmarea sau
moartea unora din celulele sale prin:
- producerea de esut fibros (septuri fibroase vascularizate)
care se interpune ntre insule de hepatocite (noduli de regenerare)
Principalele reacii patologice implicate n dezvoltarea cirozei
hepatice:
- necroza hepatocitelor - procesul iniiator i perpetuant;
- inflamaia;
- regenerarea hepato-celular;
- fibroza;
- dezorganizarea arhitecturii lobulare cu generarea de
pseudolobuli n ntregul parenchim hepatic
Pierderea elasticitii (scleroza) esutului hepatic mpiedic circulaia
sanguin, conducnd la hipertensiune portal
Ciroza = stadiul final al fibrozei hepatice
- proces ireversibil
- conduce la:
- afectarea funcional a hepatocitelor
-hipertensiunea portal (rezistena vascular intrahepatic crescut)
- dezvoltarea carcinomului hepatocelular
Ciroza micronodular
cu noduli de pn la 3 mm, care sunt
distribuii uniform n ficat
- se datorete consumului exagerat de
alcool i bolilor tractului biliar
Ciroza macronodular
cu noduli de mrimi variabile;
= rezultatul hepatitelor virale
Patogeneza fibrozei hepatice (v. Fig. slide 11)
Parenchimul hepatic conine:
- o component epitelial (hepatocite)
- o structur vascular delimitat de perei cu pori (fenestraii) =
sinusoide
- macrofage tisulare (celule Kupffer)
- celule mezenchimale perivasculare = celule stelate (anterior
denumite: celule Itto = lipocite = celule perisinusoidale = celule de
depozitare a lipidelor)
In ficatul normal:
Spaiul Disse (spatiul din jurul capilarului sinusoid, respectiv
intre peretele acestuia si celulele hepatice vecine) conine o MEC de
tip membrana bazal, esenial pentru meninerea funciilor
difereniate ale tuturor celulelor rezidente n ficat
In urma vtmrii cronice a ficatului:
- limfocitele se infiltreaz n parenchimul hepatic
- unele hepatocite sufer apoptoza
- celulele Kupffer sunt activate
fibrogenici
elibereaz mediatori pro-
- Celulele hepatice stelate (HSC) prolifereaza si sufera o
activare fenotipic
secret cantiti mari de proteine ale MEC
! HSC activate devin miofibroblaste i contraciile lor determin
creterea rezistenei la fluxul de sange prin sinusoidele hepatice
(hipertensiune portal)
- celulele endoteliale sinusoidale ii pierd fenestraiile
Modificri ale arhitecturii normale a ficatului (A) n fibroza hepatic
avansata (B)
Fibroza hepatic include nu numai modificri celulare ci i o
complexitate de modificri cantitative i calitative la nivelul
matricei extracelulare (MEC) a ficatului:
1- o cretere de 5-6 ori a moleculelor din MEC (colageni,
proteoglicani - PG, glicoproteine - GP) ca rezultat al perturbrii
echilibrului dintre sinteza i degradarea componentelor din MEC
Astfel, pe lang supraproducia de MEC se inregistreaz:
o activitatea redus a proteazelor ce degradeaz MEC
(metaloproteinaze matriceale - MMP) ca rezultat al supraexpresiei
inhibitorilor lor specifici TIMP (tissue inhibitors of metalloproteinases)
2- o cretere disproporionat a diferitelor tipuri de molecule
structurale din MEC:
- colagenul de tip I crete mai mult dect alte tipuri de
colagen
- dintre PG, creterea dermatan sulfatului (DS) este
predominant
3- apariia unor modificri subtile n microcompoziia diferitelor tipuri
de molecule din MEC, modificri ce pot afecta:
- gradul de hidroxilare a lanurilor de colagen
- gradul de sulfatare a PG
4- o redistribuire topografic a MEC n ficatul cu leziuni, ceea ce
conduce la o acumulare de esut conjunctiv (MEC) localizat
subendotelial n spaiul Disse - fibroza perisinusoidal
Fibroz perisinusoidal = mecanismul prin care se ajunge la
suferina parenchimului hepatic:
- se perturb difuzia oxigenului i substanelor nutritive de la
sinusoide spre hepatocite
- se reduce fluxul sanguin intrasinusoidal
necroza
hepatocitelor
proces inflamator
fibroza, realizndu-se astfel
un cerc vicios
III. Diabetul zaharat (Diabetes mellitus)
DZ este un sindrom caracterizat printr-un dezechilibru metabolic
ce are ca rezultat o stare de hiperglicemie datorit:
1- scderii nivelului de insulin (hormon esenial pentru
reglarea metabolismului glucidelor i transportul glucozei din snge
n interiorul celulelor) sau
2- dezvoltrii unei rezistene anormale la insulin a celulelor
insulino-sensibile
Insulina
= sintetizat de pancreas ca rspuns la o stare de hiperglicemie
- acioneaz asupra 3 tipuri celulare int principale:
- hepatocite
- celule musculare striate
- adipocite
n sensul stocrii excesului de glucoz (Glc) n structura
glicogenului, glicolizei i sintezei de acizi grai (AG)
! are efect hipoglicemiant
Diabetul zaharat de tip 1
denumit anterior IDDM (DM insulin dependent)
= diabet juvenil deoarece este depistat n perioada copilriei
Reprezint 5-10 % din totalul pacienilor cu DZ
Administrarea insulinei este indispensabil pentru supravieuire
deoarece pancreasul este incapabil s o sintetizeze n cantiti
suficiente
n lipsa administrrii insulinei pacienii mor
Exista 2 subtipuri de DZ tip I:
A- autoimun
= datorat distrugerii autoimune a celulelor ale
pancreasului, productoare de insulin
Markerii procesului autoimun = auto-anticorpi fa de
antigene specifice exprimate de celulele insulare
B- idiopatic
caracterizat prin mecanisme incomplet cunoscute de
distrugere a celulelor insulare
DZ de tip 1, netratat, este caracterizat prin urmtoarele modificri
biochimice:
a) hiperglicemie, rezult ca urmare:
- a incapacitii esuturilor de a prelua glucoza din plasm
datorit reducerii (absenei) insulinei;
- a gluconeogenezei accelerate care are ca precursori
proteinele musculare i aminoacizii.
b) hiperlipoproteinemie (valori mari de chilomicroni i VLDL)
Hiperlipoproteinemia apare datorit activitii sczute a lipoprotein
lipazei din capilarele esutului adipos (hidrolizeaz TAG din LP in 2
molecule de AG si monoacil glicerol)
- sinteza sa este dependent de insulin
c) episoade severe de cetoacidoz
= rezultatul unei cantiti mari de AcCoA provenit din:
- o lipoliza crescut n esutul adipos
- -oxidarea accelerat a acizilor grai la nivelul ficatului
n lipsa administrrii insulinei, bolnavul cu diabet tip I dezvolt:
- cetoacidoza
- coma hiperglicemic
- moarte
Patogeneza diabetului de tip 1
DZ1 este rezultatul aciunii a 3 factori:
Predispoziie genetic + factori de mediu + procese autoimune
La un individ predispus genetic, factorii de mediu induc un
proces autoimun:
Re de suprafa celular MHC-HLA: DR3, DR4 si DQ prezint
antigenele de pe suprafaa celulelor insulare limfocitelor T helper
i le stimuleaz s se multiplice.
Limfocitele T helper activate stimuleaz limfocitele B s produc
anticorpi (autoanticorpi) fa de aceste Ag specifice celulelor
conducnd la distrugerea lor i la deficiena n insulin
DIABET
Ex: diabeticii cu HLA DR3 dezvolt anticorpi fa de celulele dar nu
fa de insulin, la varst inaintat
Factori de mediu favorizanti:
Ageni infectioi, laptele de vac, deficiena n vitamina D, toxine,
factori de stres, influene climatice
IV. Boala ischemic a inimii
Ischemia = condiie patologic n care un organ are un aport de
snge insuficient
Inima: un organ puternic aerob
are o rezerv insuficient de
oxigen dac aportul de snge devine deficitar
Etiologia ischemiei cardiace:
- obturarea fluxului de sange n miocard prin blocarea
parial sau total a arterelor coronariene:
a) Ateroscleroza coronarian = proces de durat n care
lumenul arterelor ce alimenteaz inima cu snge se ngusteaz
gradat ca rezultat al depozitrii de lipide (ateroame) sau cheagurilor
de snge (tromboze) n peretele arterial, astfel nct aportul de
snge devine insuficient pentru necesitile funciei miocardice
b) Vasospasmul coronarian = o condiie patologic n care
peretele arterelor coronariene rspunde ntr-un mod hipersensibil la
un impuls vasoconstrictor normal - fie emoional, neural sau
hormonal
Efectele ischemiei asupra miocardului
1) Efecte biochimice
2) Modificri structurale
3) Eliberarea n snge a constituenilor intracelulari
1) Efecte biochimice
a) efecte determinate de hipoxia accentuat (concentraia de
oxigen n esut scade drastic)
In situaii ischemice celulele miocardice dispun doar de cteva
secunde de metabolism aerob deoarece ele folosesc rapid resursele
de oxigen rmase n microvasculatur anterior accidentului ischemic
Epuizarea aportului de oxigen
imposibilitatea continurii
fosforilrii oxidative (nu exist receptori pentru electronii ce urmeaz
a fi transportai prin catena respiratorie)
! Metabolismul miocardic se modific pentru a folosi glicogenul sau
glucoza n glicoliza anaerob
producerea de lactat i ATP
b) efecte asociate cu generarea de metabolii toxici pentru
celulele din esutul ischemic
Acumularea intracelular a lactatului, ca rezultat al dobndirii
unui metabolism anaerob de ctre celulele ischemice, reprezint unul
dintre cele mai timpurii i dramatice semne ale ischemiei miocardice.
Aceasta conduce la acidoza intracelular care afecteaz
fosfofructokinaza i prin urmare glicoliza devine ineficient
Acizii grai liberi (o alt surs de ATP n celula miocardic) nu
mai pot fi oxidai datorit lipsei aportului de oxigen i se acumuleaz
n interiorul celulelor miocardice
Pe msur ce ischemia progreseaz:
- esutul cardiac devine tot mai acid
- rezervele de creatin fosfat (depozit de legturi fosfat
energetic nalte pentru regenerarea rapid a ATP) sunt folosite i n
consecin nivelele de ATP scad
- celulele ischemice acumuleaz n exces:
- un substrat (hipoxantina) si
- o enzim (xantin oxidaza)
care reacioneaz impreun, cnd esutul este reperfuzat (irigat cu
snge aport de O2), elibernd specii reactive de oxigen care vor
distruge celulele
Daca reperfuzarea esutului ischemic este:
1- realizat n interval de 15-20 minute dup un incident
ischemic
are loc refacerea esutului deoarece celulele sunt
capabile s menin integritatea lor structural n acest interval
2- realizat n interval mai mare de 20 min (timp n care
peste 60% din rezervele de ATP sunt folosite i cantitatea de lactat
n esutul miocardic depete de ~12 ori valoarea existent n
condiii aerobe normale)
intreaga cantitate de glicogen celular
este folosit i se iniiaz moartea ireversibil a miocardului ceea ce
se exprim prin atac de cord
S-ar putea să vă placă și
- Mintea - Daniel J. SiegelDocument11 paginiMintea - Daniel J. SiegelMadalina Piştea60% (15)
- Mintea - Daniel J. SiegelDocument11 paginiMintea - Daniel J. SiegelMadalina Piştea60% (15)
- Dieta pentru zile senine II: De la durere la echilibru spiritual, psihologic, nutritivDe la EverandDieta pentru zile senine II: De la durere la echilibru spiritual, psihologic, nutritivEvaluare: 5 din 5 stele5/5 (1)
- Superintestinul: Un plan de patru săptămâni pentru reprogramarea microbiomului, refacerea sănătății și pierderea în greutateDe la EverandSuperintestinul: Un plan de patru săptămâni pentru reprogramarea microbiomului, refacerea sănătății și pierderea în greutateEvaluare: 5 din 5 stele5/5 (1)
- Capitolul I Anatomia Si Fiziologia FicatuluiDocument10 paginiCapitolul I Anatomia Si Fiziologia Ficatuluihoidrag100% (1)
- Maladii Metabolice UmaneDocument5 paginiMaladii Metabolice Umaneunafantasia92% (12)
- Cele 7 Chakre Ghidul Incepatorului de Madi BozeanuDocument11 paginiCele 7 Chakre Ghidul Incepatorului de Madi BozeanuMadalina Piştea100% (1)
- Carte Curs AnemieDocument439 paginiCarte Curs AnemieTrandescent100% (3)
- Ciroza HepaticaDocument54 paginiCiroza HepaticaIoan GruitaÎncă nu există evaluări
- Curs 3Document26 paginiCurs 3입은입은Încă nu există evaluări
- Sistemul PiramidalDocument52 paginiSistemul Piramidaldandda9393Încă nu există evaluări
- Ciroza HepaticaDocument18 paginiCiroza HepaticalarisaP100% (4)
- Semnul Rotii DintateDocument1 paginăSemnul Rotii DintateMadalina PişteaÎncă nu există evaluări
- 8.fiziopatologia Metabolismului ProteicDocument15 pagini8.fiziopatologia Metabolismului ProteicAdÎncă nu există evaluări
- Fiziologia Și Funcțiile Ficatului 2020Document11 paginiFiziologia Și Funcțiile Ficatului 2020RoxanaÎncă nu există evaluări
- Distrofiile PDFDocument20 paginiDistrofiile PDFCroitort53Încă nu există evaluări
- Ingrijirea Pacientului Cu Ciroza Hepatica AADocument11 paginiIngrijirea Pacientului Cu Ciroza Hepatica AAmihaela100% (1)
- Curs 5 AnemiiDocument60 paginiCurs 5 AnemiiMarta DumitracheÎncă nu există evaluări
- 5.tulburari Ale Metabolismului ProteicDocument9 pagini5.tulburari Ale Metabolismului ProteicClaudia PotingaÎncă nu există evaluări
- Ecografia AP Urinar MicrocursDocument31 paginiEcografia AP Urinar MicrocursMadalina Piştea100% (1)
- Fiziopatologia FicatuluiDocument11 paginiFiziopatologia Ficatuluinicole_220% (1)
- Carte Curs Anemie PDFDocument439 paginiCarte Curs Anemie PDFMihaela Cosmina NiculescuÎncă nu există evaluări
- Cap - Ii. DistrofiiDocument25 paginiCap - Ii. DistrofiiVoinea RazvanÎncă nu există evaluări
- Fiziopatologia FicatuluiDocument10 paginiFiziopatologia FicatuluiAdrian MarteaÎncă nu există evaluări
- Biochimie Clinica PDFDocument21 paginiBiochimie Clinica PDFMihail ButurăÎncă nu există evaluări
- Curs 6Document27 paginiCurs 6Anca AnkÎncă nu există evaluări
- 10Document5 pagini10Damian CojocaruÎncă nu există evaluări
- Fiziopatologia Sistemului SanguinDocument63 paginiFiziopatologia Sistemului SanguinPrisacari CristinaÎncă nu există evaluări
- Biochimie Medicala Curs 2Document31 paginiBiochimie Medicala Curs 2Andreea PetricaÎncă nu există evaluări
- Anemii MegaloblasticeDocument9 paginiAnemii MegaloblasticeAlexandru CiulicăÎncă nu există evaluări
- Carte CursDocument165 paginiCarte CursLaura CamenitaÎncă nu există evaluări
- Fiziopatologie - Curs 10-12Document10 paginiFiziopatologie - Curs 10-12GheorghiuManuelaÎncă nu există evaluări
- Fiziopatologia Insuficientei Hepatice IDocument25 paginiFiziopatologia Insuficientei Hepatice IOvidiu AioaneiÎncă nu există evaluări
- Anemii LP 1Document70 paginiAnemii LP 1Salty D0geÎncă nu există evaluări
- Biochimie Dereglarile Metabolismului Proteic Si LipidicDocument5 paginiBiochimie Dereglarile Metabolismului Proteic Si LipidicJulie laurieÎncă nu există evaluări
- SângeleDocument31 paginiSângeleAhmad AlhassanÎncă nu există evaluări
- Fiziologia EritrocitelorDocument7 paginiFiziologia EritrocitelorSandra PopaÎncă nu există evaluări
- Anemii 1Document63 paginiAnemii 1Mihaela FloreaÎncă nu există evaluări
- Curs 2Document89 paginiCurs 2입은입은Încă nu există evaluări
- Intestinul SubtireDocument8 paginiIntestinul SubtireDenis Lorena PuscasÎncă nu există evaluări
- Curs 01 Fiziopatologia-Seriei-Eritrocitare 2014Document16 paginiCurs 01 Fiziopatologia-Seriei-Eritrocitare 2014Milana MiucaÎncă nu există evaluări
- Curs 5Document8 paginiCurs 5sufaru ciprianÎncă nu există evaluări
- Tema 21Document13 paginiTema 21Anisoara GurilaÎncă nu există evaluări
- Fiziopatologie HepaticaDocument6 paginiFiziopatologie HepaticaMara BalaitaÎncă nu există evaluări
- LP Uri BIOCHIMIEDocument9 paginiLP Uri BIOCHIMIEOana OnciucÎncă nu există evaluări
- Mod - Morfologie Totalizarea 1 TeorieDocument42 paginiMod - Morfologie Totalizarea 1 TeorieAlexandru EremiaÎncă nu există evaluări
- Fizpat Curs PDFDocument149 paginiFizpat Curs PDFBianca Corina MusatÎncă nu există evaluări
- Distrofii CelulareDocument22 paginiDistrofii CelulareLivia VasileÎncă nu există evaluări
- Medicatia - Sange - 2020romDocument115 paginiMedicatia - Sange - 2020romBugetuh BcrjjcfÎncă nu există evaluări
- Fibroza HepaticaDocument8 paginiFibroza HepaticaCatalin PredaÎncă nu există evaluări
- FIZIOLOGIE Sangele1Document67 paginiFIZIOLOGIE Sangele1Mihaela VadanaÎncă nu există evaluări
- Fiziologia FicatuluiDocument49 paginiFiziologia FicatuluiAlexandra GtÎncă nu există evaluări
- Examen MorfoteorieDocument80 paginiExamen MorfoteorieNina GutanuÎncă nu există evaluări
- Metabolismul GlucidicDocument16 paginiMetabolismul GlucidicE-Printing MureșÎncă nu există evaluări
- Ciroza HepaticaDocument16 paginiCiroza HepaticaIulia Vasilica GirosanÎncă nu există evaluări
- LucrareaDocument37 paginiLucrareaStefan LunguÎncă nu există evaluări
- Eritropoieza Si CoagulareaDocument6 paginiEritropoieza Si Coagulareacristina_zaharia865440Încă nu există evaluări
- Curs Ficat RedDocument50 paginiCurs Ficat RedConstantin OleseaÎncă nu există evaluări
- Mutatii Metabolice EreditareDocument21 paginiMutatii Metabolice EreditareLore LorenaÎncă nu există evaluări
- 4 Functia Excretorie A FicatuluiDocument6 pagini4 Functia Excretorie A FicatuluiMarcela-Felicia BalanÎncă nu există evaluări
- Fiziopatologia Sangelui RosuDocument32 paginiFiziopatologia Sangelui RosuAlina VerdesÎncă nu există evaluări
- GlucozaDocument35 paginiGlucozaMadalina PişteaÎncă nu există evaluări
- CarcinogenezaDocument58 paginiCarcinogenezaMadalina PişteaÎncă nu există evaluări
- Flagelate CavitareDocument3 paginiFlagelate CavitareMadalina PişteaÎncă nu există evaluări