Documente Academic
Documente Profesional
Documente Cultură
Proiect
Încărcat de
cocoDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Proiect
Încărcat de
cocoDrepturi de autor:
Formate disponibile
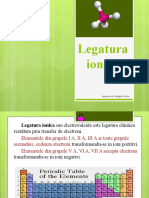
COMPUSI IONICI
Prezentat de: Cires Darius Cozma Alexandru Craciun Alex Moldovan Antonio
Cuprins: Definitia compusilor ionici Date generale despre legatura ionica Legatura ionica Retele ionice Proprietati ale substantelor ionice Surse
COMPUSII IONICI
Compuii ionici sunt formai din ioni de semn contrar coninui n rapoarte de numere ntregi,astfel ca suma sarcinilor electrice ale ionilor s fie egal cu 0, pentru a asigura electroneutralitatea compusului. Regula pentru determinarea formulei unui compus ionic este : b+ bNumrul sarcinilor (+)=Numrul sarcinilor (-),astfel c,pentru un compus X a Yb, numrul de ioni (+) x sarcina electric a ionului (+) = numrul de ioni (-) x sarcina electric a ionului (-) sau a(+b) + b(-a) = 0. Formula compuilor ionici indic natura ionilor i raportul n care ionii de semn contrar se gsesc n reea;ea nu corespunde unei molecule.
Legtura ionic sau electrovalent a fost dezvoltat de J.J.Berzelius (2 august 1779 - 7 august 1848). W. Kossel (4 ianuarie 1888- 22 mai 1956) a reluat teoria dualist punnd-o n acord cu concepiile asupra structurii atomului. El a scos n eviden faptul c n procesul de pierdere i ctig de electroni se tinde ca ionii s aib o structur electronic de tip gaz inert, adic o structur extern de 8 sau 18 electroni, care e foarte stabil. Teoria sa se numete teoria octetului.
Legtura ionic este un tip de legtur chimic intramolecular ce se realizeaz prin transfer de electroni ntre atomi de elemente cu caracter chimic opus. Atomii astfel construii n stare solid se organizeaz sub form de cristale, care datorit tipului de legtur se numesc cristale ionice.Cristalele ionice tipice se formeaz ca rezultat al reaciei dintre un element metalic puternic electropozitiv (grupele I,II) cu un element puternic electronegativ (grupele VI, VII).
Etapele care trebuie parcurse pentru a crea o legtur ionic sunt formarea ionilor i atracia electrostatic a acestora.
REELE IONICE
n starea solid,compuii ionici formeaz reele ionice.
Caracteristic pentru reelele ionice este faptul c ionii pozitivi alterneaz cu ionii negativi,ocupnd poziii bine determinate i ntre ioni se exercit fore de atracie electrostatice. Unul dintre cei mai cunoscui compui ionici,clorura de sodium.Retele de acelai tip cu NaCl mai formeaz : NaF,KBr,NaI, MgO,AgF,AgCl,CaS. Ionii de Na i Cl ocup alternativ poziii bine precizate n reeaua de NaCl;astfel,fiecare ion de Na interacioneaz electrostatic cu un numr de 6 ioni de Cl ,situai n imediata apropiere.n mod similar,fiecare ion de Cl este nconjurat de ioni de Na .Numrul ionilor de semn contrar,situai n imediata vecintate,cu care se nconjoar un ion,reprezint numrul de coordinare,N.C.. Raportul dintre numrul ionilor cu sarcini de semn contrar este de 1:1,aa c,n ansamblu,cristalul de NaCl este neutru din punct de vedere electric.
PROPRIETATI ALE SUBSTANTELOR IONICE
1).STAREA DE AGREGARE -In conditii normale de temperatura,substantele ionice sunt solide,cristalizate. Punctele de topire si de fierbere ale compusilor ionici au valori mari,deoarece legatura ionica este o legatura puternica. -Dimensiunile ionilor au un rol important in determinarea structurii si stabilitatii cristalului ionic.Punctele de topire ale compusilor ionici sunt cu atat mai mari cu cat raza ionilor este mai mica.
2).REZISTENTA MECANICA -Cristalele ionice se sfarama sub actiunea unei forte mecanice. 3).SOLUBILITATEA -Majoritatea compusilor ionici sunt solubili in solventi polari,asa cum este apa. 4).CONDUCTIBILITATEA ELECTRICA -Cristalele ionice nu conduc curentul electric in stare solida,deoarece ionii ocupa pozitii fixe in reteaua cristalina.Ionii sunt mentinuti in aceste pozitii datorita legaturii ionice puternice. -In stare lichida sau in solutie,ionii devin mobili;sub actiunea unei diferente de potential,ionii se pot deplasa spre electrozi,facand posibila trecerea curentului electric. Substantele care permit trecerea curentului electric prin solutie sau topitura poarta numele de electroliti.
Va multumim pentru atentie.
Surse: www.Wikipedia.com www.chimie-online.ro
Sfarsit
S-ar putea să vă placă și
- Legatura IonicaDocument7 paginiLegatura IonicaDomnica SapojnicÎncă nu există evaluări
- Compusi IoniciDocument10 paginiCompusi IoniciDenisa100% (1)
- Legatura Ionica NaClDocument1 paginăLegatura Ionica NaClLuc SanduÎncă nu există evaluări
- Rețele IoniceDocument1 paginăRețele IoniceFlorina VisanÎncă nu există evaluări
- Referat NanochimieDocument7 paginiReferat NanochimieDoar FericireaÎncă nu există evaluări
- Legaturi-Chimice CovalenteDocument96 paginiLegaturi-Chimice CovalenteAda RusuÎncă nu există evaluări
- Legaturi ChimiceDocument8 paginiLegaturi ChimiceMiha BChÎncă nu există evaluări
- Legatura Ionica Referat ChimieDocument7 paginiLegatura Ionica Referat ChimieArnautu Radu Gabriel50% (2)
- Chimie Generala Curs 5Document33 paginiChimie Generala Curs 5Milena Negru100% (1)
- Legaturi ChimiceDocument36 paginiLegaturi ChimiceIrina Tamas100% (1)
- Prin Transformari ChimiceDocument7 paginiPrin Transformari ChimiceSabados IonuțÎncă nu există evaluări
- Chimie - Legaturi ChimiceDocument8 paginiChimie - Legaturi ChimiceElenaVicolÎncă nu există evaluări
- Legaturi ChimiceDocument3 paginiLegaturi ChimiceBabinion1994Încă nu există evaluări
- Curs 2Document25 paginiCurs 2Bosie IonutÎncă nu există evaluări
- Legătura ChimicăDocument8 paginiLegătura ChimicălucianaÎncă nu există evaluări
- Legaturi ChimiceDocument5 paginiLegaturi ChimiceRoxana SanduÎncă nu există evaluări
- Legatura IonicaDocument21 paginiLegatura IonicaKlausÎncă nu există evaluări
- Legatura IonicaDocument2 paginiLegatura IonicaErica PetricioiuÎncă nu există evaluări
- 3.1. Legatura IonicaDocument2 pagini3.1. Legatura IonicaANDREEA SOSDEANU100% (1)
- Cursul 8Document10 paginiCursul 8FertuGabrielÎncă nu există evaluări
- VFHGVDocument22 paginiVFHGVLori SzollosyÎncă nu există evaluări
- Legătura Chimică 2.1 Legătura Ionică: 2.1.1 Reţele IoniceDocument24 paginiLegătura Chimică 2.1 Legătura Ionică: 2.1.1 Reţele IoniceDana CapbunÎncă nu există evaluări
- Ui 4 PDFDocument20 paginiUi 4 PDFOanaMariaÎncă nu există evaluări
- WWW - Referate.ro-Legatura Ionica 0be31Document5 paginiWWW - Referate.ro-Legatura Ionica 0be31Octavian IoghenÎncă nu există evaluări
- 11 12-28-011 CristalochimieDocument33 pagini11 12-28-011 CristalochimieCotoi IonutÎncă nu există evaluări
- LEGATURI INTRAMOLECULARE Si INTERMOLECULAREDocument116 paginiLEGATURI INTRAMOLECULARE Si INTERMOLECULAREmyaccountonscribdÎncă nu există evaluări
- Legaturi ChimiceDocument8 paginiLegaturi Chimicemadalina942000100% (1)
- Tipuri de Legaturi Chimice Clasice Si IntermoleculareDocument4 paginiTipuri de Legaturi Chimice Clasice Si IntermoleculareMihai qkÎncă nu există evaluări
- 0 Legatura IonicaDocument10 pagini0 Legatura IonicaMariana GoguÎncă nu există evaluări
- Legătura IonicaDocument11 paginiLegătura IonicaMadalina PopescuÎncă nu există evaluări
- Legatura MetalicaDocument35 paginiLegatura MetalicaAndrei ValeanuÎncă nu există evaluări
- Lectia 2 - Legaturi ChimiceDocument18 paginiLectia 2 - Legaturi ChimiceandreivladÎncă nu există evaluări
- Întrebări Partea 1 ChimieDocument4 paginiÎntrebări Partea 1 ChimieAxu KarouÎncă nu există evaluări
- Vdocuments - MX Legatura Ionica Si CovalentaDocument16 paginiVdocuments - MX Legatura Ionica Si CovalentaFLORENTINA NICAÎncă nu există evaluări
- Cap3 - LEGATURI CHIMICE - 09Document20 paginiCap3 - LEGATURI CHIMICE - 09Campan Claudiu100% (2)
- Cap3 - LEGATURI CHIMICE - 10Document23 paginiCap3 - LEGATURI CHIMICE - 10Bianca BadoiuÎncă nu există evaluări
- Biofizica - MoleculeDocument2 paginiBiofizica - MoleculeJacques de MolayÎncă nu există evaluări
- Legaturi ChimiceDocument27 paginiLegaturi ChimiceMVÎncă nu există evaluări
- Legaturi Chimice CG 2016Document48 paginiLegaturi Chimice CG 2016Dan AlecsandruÎncă nu există evaluări
- CristalochimieDocument27 paginiCristalochimieHelene CramÎncă nu există evaluări
- Legatura IonicăDocument8 paginiLegatura IonicăBianca BledeaÎncă nu există evaluări
- Copie A Basic Chemistry For Pre-K by SlidesgoDocument12 paginiCopie A Basic Chemistry For Pre-K by SlidesgomayaÎncă nu există evaluări
- 3 Tema-84788Document46 pagini3 Tema-84788Andreea SpataruÎncă nu există evaluări
- Lectia04 1. Legatura Ionica 2. Cristalul de Clorura de Sodiu NaClDocument2 paginiLectia04 1. Legatura Ionica 2. Cristalul de Clorura de Sodiu NaClivan turcan71% (7)
- Legătura ChimicăDocument3 paginiLegătura ChimicăPirvan Alina IÎncă nu există evaluări
- CHIMIEDocument6 paginiCHIMIETITEL RADUÎncă nu există evaluări
- Structura MoleculeiDocument31 paginiStructura MoleculeiStefan NegoitaÎncă nu există evaluări
- Tipuri de Legaturi ChimiceDocument2 paginiTipuri de Legaturi ChimiceraluÎncă nu există evaluări
- Legatura Ionica Si CovalentaDocument16 paginiLegatura Ionica Si CovalentaGheorghe Valentin100% (1)
- Legaturi ChimiceDocument23 paginiLegaturi ChimiceIonela RotaruÎncă nu există evaluări
- 0 Legatura IonicaDocument11 pagini0 Legatura IonicaOxana Cucos-FloreaÎncă nu există evaluări
- LEGĂTURA IONICĂ.Cristalul de Clorură de SodiuDocument1 paginăLEGĂTURA IONICĂ.Cristalul de Clorură de SodiuDorinCbzÎncă nu există evaluări
- Legătură MetalicaDocument70 paginiLegătură MetalicaVlad ȘtefanÎncă nu există evaluări
- Cristalul de NaClDocument3 paginiCristalul de NaClAndrei Vanghele50% (4)
- Cristale IoniceDocument6 paginiCristale IoniceMădălina Frunzete0% (1)
- Legătura IonicăDocument3 paginiLegătura IonicăAlexia RărișÎncă nu există evaluări
- Notiuni de Biofizica Moleculara Si SolutiiDocument5 paginiNotiuni de Biofizica Moleculara Si Solutiiime imeÎncă nu există evaluări
- 2014-Volkswagen-Replacing Light Bulbs RODocument13 pagini2014-Volkswagen-Replacing Light Bulbs ROcocoÎncă nu există evaluări
- Cerere Declaratie Plafonare CasniciDocument2 paginiCerere Declaratie Plafonare CasnicicocoÎncă nu există evaluări
- ANEXA 1 - Cerere Duplicat Model Nou 04.06.2018 Cu GDPRDocument1 paginăANEXA 1 - Cerere Duplicat Model Nou 04.06.2018 Cu GDPRcocoÎncă nu există evaluări
- Manual de Utilizare Q3RF-computhermDocument28 paginiManual de Utilizare Q3RF-computhermcocoÎncă nu există evaluări
- Manual Frigider Beko 250 LitriDocument12 paginiManual Frigider Beko 250 LitriPerfectreviewÎncă nu există evaluări
- Model de CerereDocument1 paginăModel de CerereVasile AlinaÎncă nu există evaluări
- Model Declaratie Proprie RaspundereDocument2 paginiModel Declaratie Proprie RaspundereVasile AlinaÎncă nu există evaluări
- Carti. Caiet - Special.de - Matematica. Clasa.1 Ed - Aramis. TEKKENDocument114 paginiCarti. Caiet - Special.de - Matematica. Clasa.1 Ed - Aramis. TEKKENcoco100% (1)
- Informatii Pagubiti FniDocument2 paginiInformatii Pagubiti Fnicoco100% (1)
- Carte Retete Delimano Air FryerDocument40 paginiCarte Retete Delimano Air Fryercuick100% (6)
- 02 Melinda Katalogus Tevi Si FitinguriDocument118 pagini02 Melinda Katalogus Tevi Si FitinguriGeorge LupusorÎncă nu există evaluări
- PURE Brosura 2016 RO 1463231656Document3 paginiPURE Brosura 2016 RO 1463231656cocoÎncă nu există evaluări
- 12.OMAI 163 Din 2007Document38 pagini12.OMAI 163 Din 2007DeeaDeeaÎncă nu există evaluări
- Scenete HaioaseDocument9 paginiScenete HaioaseSima Gabriela94% (16)
- Energia UniversalaDocument47 paginiEnergia Universalaliana68ro97% (34)
- 2014 Catalogsurubexpert PDFDocument46 pagini2014 Catalogsurubexpert PDFcocoÎncă nu există evaluări
- EDMUNDO - Informatii Danemarca 2015Document3 paginiEDMUNDO - Informatii Danemarca 2015cocoÎncă nu există evaluări
- Referat Despre PoluareDocument3 paginiReferat Despre PoluarecocoÎncă nu există evaluări
- Abraham Hicks - Creaţia Se Referă La Tine Scara EmoţiilorDocument7 paginiAbraham Hicks - Creaţia Se Referă La Tine Scara EmoţiilorGlaremagazine Kuberamedia100% (1)
- DreptateaDocument1 paginăDreptateacocoÎncă nu există evaluări
- Scenete HaioaseDocument9 paginiScenete HaioaseSima Gabriela94% (16)
- Ultima Noapte de Dragoste Tema Si Viziunea Despre LumeDocument2 paginiUltima Noapte de Dragoste Tema Si Viziunea Despre Lumecoco100% (1)
- Documentatia Necesara Pentru Burse Bani de Liceu Rechizite - An Scolar 2014-2015Document4 paginiDocumentatia Necesara Pentru Burse Bani de Liceu Rechizite - An Scolar 2014-2015cocoÎncă nu există evaluări
- AalborgUCNComputer ScienceDocument2 paginiAalborgUCNComputer SciencecocoÎncă nu există evaluări
- Noodles Cu Pui - RetetaDocument1 paginăNoodles Cu Pui - RetetacocoÎncă nu există evaluări
- Pui Gong BaoDocument2 paginiPui Gong BaococoÎncă nu există evaluări
- Catalog Fmgroup 21Document43 paginiCatalog Fmgroup 21Liliac41Încă nu există evaluări
- Civil Fara Cereri La 31 Martie 2015Document144 paginiCivil Fara Cereri La 31 Martie 2015cocoÎncă nu există evaluări
- Criterii SelectieDocument1 paginăCriterii SelectieNicoleta MarianÎncă nu există evaluări
- Variante Bacalaureat Matematica M1 2009Document100 paginiVariante Bacalaureat Matematica M1 2009Scutariu Silviu94% (16)