Documente Academic
Documente Profesional
Documente Cultură
Biochimie 1
Încărcat de
bella17Titlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Biochimie 1
Încărcat de
bella17Drepturi de autor:
Formate disponibile
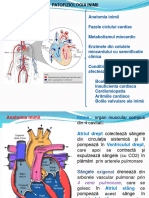
BIOCHIMIA APARATULUI CARDIOVASCULAR
Cea mai frecventă modificare patologică care afectează funcţia cardiacă este, paradoxal, ischemia
(lipsa unui flux sangvin adecvat care să asigure oxigenul necesar funcţionării miocardului). Deşi
inima pompează în fiecare minut câţiva litri de sânge, vascularizaţia şi transportul de sânge arterial
la inimă se realizează prin arterele coronare care pot fi afectate de ateroscleroză (proces cronic de
afectare a endoteliului vascular prin care se produc plăci aterosclerotice ce pot obtura parţial sau
total lumenul vascular, diminuând în consecinţă fluxul sangvin; de asemenea plăcile aterosclerotice
favorizează apariţia trombilor sangvini ce pot bloca total sau parţial ramurile arterelor coronare,
apărând sindromul coronarian acut). Grupul de boli ce se dezvoltă în urma afectării fluxului
sangvin coronarian constituie boala coronariană, manifestarea ei cea mai gravă fiind infarctul
miocardic acut (IMA), când arterele coronare sau ramurile lor sunt blocate total şi apare necroza
celulelor miocardului. I. Biomarkeri ai leziunilor cardiace ischemice În funcţie de dimensiunea
teritoriului necrozat, moartea celulară va determina eliberarea a numeroşi compuşi biochimici, mai
mult sau mai puţin specifici miocardului a căror determinare poate stabili un diagnostic pozitiv
rapid, esenţial pentru salvarea vieţii pacientului. Dintre biomarkerii asociaţi ischemiei şi necrozei
celulelor cardiace, în prezent, cel mai specific şi sensibil biomarker este considerat a fi troponina
cardiacă. Alţi biomarkeri cardiaci utili în diagnostic sunt: creatinkinaza (CK: CK total şi izoenzima
CK-MB), ASAT (GOT), LDH, mioglobina, dar specificitatea lor este mai mică fiind regăsite şi în
alte teritorii tisulare. Evoluţia concentraţiei biomarkerilor cardiaci pentru necroza celulelor
miocardice, precum și a biomarkerilor pentru diferențierea acesteia de alte patologii, este diferită în
intervalul de timp scurs de la evenimentul ischemic (Tabelul 1 şi Figura 1).
Tabelul 1. Principalele caracteristici ale biomarkerilor cardiovasculari Marker cardiac Greutate
moleculară (GM, Da) Debut (ore) Maxim (ore) Dispariţie (zile) CK 80000 4-8 18-30 3-4 CK-MB
80000 3-8 12-24 2-3 LDH 135000 8-12 48-72 8-14 Mioglobină 18000 1-3 6-9 1 Troponină I 24000
3-8 24-48 4-10 Troponină T 37000 3-8 24-48 4-10 ASAT (GOT) 72-96 5-6 zile 12-14 D-Dimeri
200000 4-8 12-24 2-4 Peptidul natriuretic de tip B (BNP) 8-12 12-24 2-3
Figura 1. Evoluţia în timp a concentraţiilor biomarkerilor din IMA
1. Troponina cardiacă Troponina (Tn) este un complex reglator format din 3 proteine localizat la
intervale regulate în filamentele subţiri ale muşchilor striaţi (compuse din actină, tropomiozină şi
troponină). Cele trei proteine individuale sunt: TnT (subunitatea legată de tropomiozină, 37kDa),
TnI (subunitatea inhibitoare, legată de actină, 24k Da), şiTnC (subunitatea ce leagă Ca2+, 18kDa).
În starea de relaxare musculară, TnI este legată de actină, blocând legarea acesteia de miozină.
Declanşarea contracţiei musculare se realizează de către Ca2+ care se leagă de TnC, cauzând o
modificare conformaţională care desprinde TnI de pe actină, permiţând ca interacţiunea între actină
şi miozină să aibă loc. Spre deosebire de ceilalţi markeri, formele de Tn din muşchii scheletici şi
cardiaci diferă. Pentru TnC formele găsite în fibrele de tip 2 ale muşchilor scheletici şi miocard
sunt identice, făcând imposibilă utilizarea acesteia ca marker diferenţial. TnI are o formă
cardiospecifică (cTnI=cardiac TnI), cât şi forme diferite în fibrele muşchilor striaţi de tip 1 şi tip 2,
fiecare fiind codată de o genă separată. TnT prezintă forme distincte în miocard (cTnT=cardiac
TnT), muşchi scheletici cu contracţie rapidă şi contracţie lentă, însă cTnT a fost detectată în muşchi
scheletici fetali şi în muşchi scheletici bolnavi. În orice caz, modificările posttranslaționale produc
diferenţe detectabile între cTnT produsă în miocard şi cTnT produsă în muşchi scheletici bolnavi,
astfel încât testele comerciale de analiză din generaţia curentă (ELISA), ar trebui să aibă
specificitate miocardică aproape de 100%. Totuşi, creşteri uşoare de cTnT circulant, utilizând chiar
teste de analiză mai noi, au fost raportate la pacienţi cu distrofie musculară şi insuficienţă renală,
care nu prezintă alte dovezi de boală cardiacă. În miocitele cardiace, cTnT şi cTnI sunt legate
predominant de fibre musculare, cum s-a descris mai sus, iar forma legată este eliberată încet, în
decursul a 1-2 săptămâni după infarctul miocardic. Astfel, desi cTnI şi cTnT sunt proteine relativ
mici, care sunt rapid eliminate, nivelul lor plasmatic scade încet după leziuni cardiace. O fracţiune
mică de cTn din celulele miocardiace se găseşte liberă în citoplasmă (în medie 6% pentru cTnT şi
2,5 % pentru cTnI). Fracţiunea liberă este
eliberată timpuriu din celulele miocardice afectate şi permite detecţia ei într-un interval de timp
similar cu CK-MB, cTn atingând un maxim la aproximativ 24 de ore după infarctul miocardic.
Datorită eliberării lente a fracţiunii de cTn legate, scăderea rapidă a cTn circulant imediat după
atingerea maximului, este urmată de un platou sau chiar de o uşoară creştere secundară. Este
important ca o asemenea creştere sa nu fie interpretată ca un marker al unui alt infarct. cTn circulant
scade la valori normale după 5-10 zile, în funcţie de dimensiunea infarctului.
2. Creatin kinaza (CK) CK este o enzimă dimerică formată din 2 subunităţi catalitice (lanţuri
polipeptidice cu structură diferită, având greutatea moleculară de aprox. 40 kDa fiecare) numite M
(muscle=muşchi) şi respectiv B (brain=creier). Cele 3 izoenzime care rezultă prin asocierea celor
două subunităţi sunt: CK-BB (CK1, conţinând 2 lanţuri B), CK-MB (CK2, conţinând un lanţ B şi
un lanţ M), CK-MM (CK3, conţinând 2 lanţuri M). CK este răspândită în întreg organismul, având
însă cele mai mari concentraţii în muşchi şi creier, deşi practic CK din creier nu străbate bariera
hemato-encefalică pentru a ajunge în plasmă. În creier şi în muşchiul neted izoenzima dominantă
este CK-BB. În cordul normal, un procent de 15-20% din CK este reprezentată de CK-MB restul
fiind CK-MM, care însă nu este uniform răspândită, o cantitate mai mare găsindu-se în cordul drept
comparativ cu cordul stâng. CK-MB reprezintă 0-1% din CK în fibrele de tip 1 din muşchiul
scheletic şi 26% în fibrele de tipul 2. De asemenea, se observă o producţie sporită de CK-MB
comparativ cu producţia de CK-MM în timpul procesului de regenerare musculară. Concentraţia
serică a CK şi a CK-MB începe să crească la 3-8 ore după producerea IMA, iar cantitatea eliberată
este proporţională cu masa necrozei. Enzima atinge un maxim la 24 ore şi revine la valoarea
normală după 48-72 ore (Figura 1). Determinarea fracţiunii CK-MB se realizează prin tehnici
imunometrice, fiind o determinare cantitativă (nu se determină activitatea enzimatică). Datorită
faptului că CK-MB nu este specifică în totalitate miocardului (există şi în muşchii striaţi), mai util
în diagnosticul de laborator al IMA este raportul dintre CK-MB (exprimată cantitativ ca şi
concentraţie) şi activitatea CK total (măsurată ca activitate enzimatică, U/L, această determinare
fiind mai accesibilă din punct de vedere al costului), numit index relativ (IR) sau procentaj relativ,
deoarece se utilizează unităţi de măsură diferite pentru cele două componente din raport. Un IR mai
mare este caracteristic pentru IMA, iar CK-MB trebuie să depăşească limita superioară a
intervalului de referinţă atât cantitativ (>5 ng/ml) cât şi procentual prin calculul IR (>6%). De
asemenea, pentru un diagnostic exact, trebuie luată în considerare şi evoluţia în timp a concentraţiei
enzimei (Figura 1). Supuse electroforezei, două izoenzime CK (CK-MB şi CK-MM) prezintă la
rândul lor specii moleculare diferite numite izoforme, care iau naştere sub acţiunea a unor
carboxipeptidaze serice care hidrolizează resturile terminale de lizină (Liz) ale subunităţii M.
Astfel CK-MB poate avea un rest de Liz hidrolizat (CK-MB1) sau nici unul (CKMB2), în timp ce
CK-MM poate avea lizate un rest de lizină (CK-MM2), două resturi de Liz (CK-MM1) sau nici
unul (CK-MM3). Această modificare prin care iau naştere izoformele CK apare doar după
eliberarea enzimelor în sânge în urma leziunilor tisulare. Astfel, în IMA, izoformele native, tisulare,
fără resturi de lizină hidrolizate ale CK (CK-MB2 şi CK-MM3) sunt eliberate în circulaţie fiind
nevoie de câteva ore pentru a se transforma în izoformele CK-MB1 şi CK-MM1/CK-MM2.
În consecinţă, un raport mai mare CK-MB2/CK-MB1 şi CK-MM3/CK-MM1 arată că a avut loc o
eliberare recentă de enzime în circulaţie. Această creştere a raportului izoformelor se observă cu
puţin timp înainte ca CK-MB seric se depăşească limita superioară a intervalului de referinţă, astfel
încât, în primele 3-4 ore de la debutul simptomelor, prin această determinare se poate mări
sensibilitatea diagnosticului de IMA. Testarea se poate realiza cu un sistem rapid de electroforeză
care însă va rămâne dedicat acestui tip de analiză. 3. LDH (lactat dehidrogenaza) LDH este o
enzimă cu Zn, cu greutate moleculară de 135 kDa, având o structură tetramerică ce implică două
subunităţi, H (heart=inimă) şi M (muscle=muşchi). Prin combinarea celor 2 subunităţi rezultă 5
izoenzime: LDH1 (HHHH), LDH2 (HHHM), LDH3 (HHMM), LDH4 (HMMM) şi LDH5
(MMMM). Izoenzima LDH1 este relativ abundentă în miocard, iar izoenzima LDH5 este mai
răspândită în muşchii striaţi. Este un marker de necroză miocardică mai puţin specific care
contribuie alături de CK la diagnosticul tardiv al IMA, cinetica sa plasmatică fiind lentă (Figura 1).
Dezavantajul său este specificitatea foarte slabă pentru miocard, mai putând fi eliberată din
muşchiul scheletic, plămân, rinichi, ficat, eritrocite. Specificitatea LDH este crescută prin analiza
activităţii izoenzimei LDH1. Activitatea LDH1 creşte în 8-12 ore de la debutul necrozei, atinge un
maxim la 48-72 ore şi revine la normal în 8-14 zile după IMA. Pentru că timpul de înjumătăţire este
prelungit, LDH1 este utilă pentru diagnosticul pacienţilor prezentaţi tardiv. Creşterea raportului
LDH1/LDH2 peste 0,75, determinată de mărirea concentraţiei LDH1 faţă de LDH2 (normal
LDH2>LDH1), are o sensibilitate şi o specificitate de peste 90% pentru necroza miocardică. În
prezent este o determinare rar utilizată comparativ cu markerii de elecţie (cTn, CK-MB). 4.
Mioglobina Mioglobina este o hemoproteină care leagă oxigenul în muşchii scheletici şi miocard.
Există o singură formă comună ambelor tipuri de muşchi. Lipsindu-i specificitatea cardiacă,
utilitatea mioglobinei derivă din cinetica acesteia (Figura 1). Având o greutate moleculară de doar
18 kDa, se difuzează din celulele afectate mai rapid decât celelalte proteine. Concentraţii serice
mărite apar după 1-3 ore de la primele simptome ale IMA, mai rapid decât în cazul troponinei sau al
altor markeri. Mioglobina se elimină în principal prin filtrare glomerulară. Timpul de înjumătăţire
este de aproximativ 4 ore, dar este mai lung dacă funcţia renală este alterată. În mod caracteristic,
nivelul de mioglobină atinge un maxim la aproximativ 6-9 ore după IMA şi revine la valori normale
după 24 de ore. La indivizii sănătoşi, nivelul mioglobinei depinde de masa musculară şi activitatea
musculară, similar cu tiparul CK. Nivelele plasmatice sunt mai ridicate la bărbaţi decât la femei.
Nivelul de mioglobină creste cu vârsta, reflectând scăderea vitezei de filtrare glomerulară. Variaţia
zilnică este de aproximativ 10-15%. In ciuda lipsei de specificitate a mioglobinei pentru miocard,
ca test pentru IMA oferă specificitate clinică destul de ridicată (95%), atunci când pacienţii cu
insuficienţă renală sau cei suspecţi de boli musculare sunt excluşi. Specificitatea mioglobinei poate
fi crescută prin măsurarea simultană a anhidrazei carbonice III (ACIII), care este prezentă în
muşchiul scheletic dar nu şi în muşchiul cardiac.
Raportul mioglobină/ACIII va creşte în IMA şi nu va creşte în leziuni ale muşchiului scheletic.
Sensibilitatea mioglobinei poate fi mărită prin considerarea unui rezultat pozitiv atunci când, chiar
dacă valoarea se încadrează în intervalul de referinţă, aceasta a suferit o modificare considerabilă
(delta mioglobina), faţă de o determinare a unei probe de la acelaşi pacient cu 1-3 ore anterior.
5. Transaminaza ASAT (GOT) Este unul din primii markeri enzimatici care a fost utilizat pentru
diagnosticul IMA, în prezent fiind înlocuit cu markeri mult mai specifici, prezentaţi anterior.
Enzima este eliberată consecutiv necrozei miocardice, dar nu este specifică. Activitatea sa poate să
crească şi în boli de citoliză hepatică (ficatul de stază), afecţiuni pulmonare (tromboembolismul
pulmonar), afecţiuni şi traumatisme musculare, gangrene, anemii hemolitice, pancreatite acute.
Cinetica este similară CK
S-ar putea să vă placă și
- LP 5Document8 paginiLP 5ELISEI PUPÎncă nu există evaluări
- BCH 3 C15BiochimieDocument33 paginiBCH 3 C15BiochimieRaul LeucianÎncă nu există evaluări
- Curs 1 - Biochimie ClinicaDocument10 paginiCurs 1 - Biochimie ClinicaDelia NutuÎncă nu există evaluări
- Tema 2 Informatie Total - Singele-67175Document23 paginiTema 2 Informatie Total - Singele-67175Elena JacotaÎncă nu există evaluări
- Tema 2 Informatie Total - Singele-68262Document28 paginiTema 2 Informatie Total - Singele-68262Vlad PopaÎncă nu există evaluări
- Creatin Kinaza LDHDocument7 paginiCreatin Kinaza LDHPaul-Sergiu GainaÎncă nu există evaluări
- Enzimele Markeri Biochimici Ai Infarctului MiocardicDocument6 paginiEnzimele Markeri Biochimici Ai Infarctului MiocardicAnna MirelaÎncă nu există evaluări
- Analiza ClinicaDocument7 paginiAnaliza ClinicaValentina RoznovÎncă nu există evaluări
- Enzimiologie ClinicaDocument47 paginiEnzimiologie ClinicaAlexandru BarbuÎncă nu există evaluări
- Troponina T STATDocument5 paginiTroponina T STATDanaÎncă nu există evaluări
- Curs 6 MDU CompDocument73 paginiCurs 6 MDU CompzdravcovlauraÎncă nu există evaluări
- Medicamente Cu Actiune Cardiovasculara SimpatomimeticeleDocument14 paginiMedicamente Cu Actiune Cardiovasculara SimpatomimeticeleDragos ZaicescuÎncă nu există evaluări
- 4.proprietati MecaniceDocument88 pagini4.proprietati MecaniceCiprian JurjeÎncă nu există evaluări
- Proprietati Mecanice Ale Cordului AV PDFDocument88 paginiProprietati Mecanice Ale Cordului AV PDFertgfdsasÎncă nu există evaluări
- Cardio Oana 1Document35 paginiCardio Oana 1oanaÎncă nu există evaluări
- Istr. CPIDocument64 paginiIstr. CPIAnastasia Boaghi GavriliţăÎncă nu există evaluări
- Curs 5 Corticosuprarenale, MedulosuprarenaleDocument19 paginiCurs 5 Corticosuprarenale, MedulosuprarenaleMihai VidreanÎncă nu există evaluări
- Curs Teoretic. Insuficiența CardiacăDocument38 paginiCurs Teoretic. Insuficiența CardiacăJora IonÎncă nu există evaluări
- CV10 - 2019-2020Document65 paginiCV10 - 2019-2020Xerox medÎncă nu există evaluări
- HTADocument12 paginiHTAandrei0891Încă nu există evaluări
- Curs 3 Cardiac MGII RO 2023Document21 paginiCurs 3 Cardiac MGII RO 2023Pop DavidÎncă nu există evaluări
- Curs 4 - Markeri Biochimici in Bolile Cardiovasculare Si Perturbarea Functiei Ficatului 01.04. 2015Document29 paginiCurs 4 - Markeri Biochimici in Bolile Cardiovasculare Si Perturbarea Functiei Ficatului 01.04. 2015Moloce BeatriceÎncă nu există evaluări
- Factorii TrigerDocument2 paginiFactorii TrigerConstantin ElenaÎncă nu există evaluări
- Ischemie Leziune NecrozaDocument83 paginiIschemie Leziune NecrozaVisan Andreea Mihaela Ramona100% (1)
- Biochimie Medicala Curs 8Document43 paginiBiochimie Medicala Curs 8Andreea PetricaÎncă nu există evaluări
- Electronica MedicalăDocument5 paginiElectronica MedicalăZgherea Mihai100% (1)
- Cap2-Activitatea Electrica A InimiiDocument23 paginiCap2-Activitatea Electrica A InimiiRazvaniQQQ77777100% (1)
- Capitolul 2 - CordDocument39 paginiCapitolul 2 - CordBianca ChelaruÎncă nu există evaluări
- Proteine Si Gene Implicate in Strestul Oxidativ Si Metabolismul Sistemului Nervos Central Dupa Ischemie FocalaDocument10 paginiProteine Si Gene Implicate in Strestul Oxidativ Si Metabolismul Sistemului Nervos Central Dupa Ischemie FocalaIoana AndoneÎncă nu există evaluări
- Capitol 1 Sectiunea 2Document397 paginiCapitol 1 Sectiunea 2cosmin1987Încă nu există evaluări
- Fiziologia Sistemului Cardiovascular (Pseudosuport de Curs)Document6 paginiFiziologia Sistemului Cardiovascular (Pseudosuport de Curs)Alexandra DobricăÎncă nu există evaluări
- Fiziopatologia AterosclerozeiDocument12 paginiFiziopatologia AterosclerozeiКристина ДюшесÎncă nu există evaluări
- Factor de conversie:U/L X 0.0167 Mkat/lDocument3 paginiFactor de conversie:U/L X 0.0167 Mkat/lrdacianaÎncă nu există evaluări
- Fiziopat TotDocument56 paginiFiziopat TotElena IonÎncă nu există evaluări
- Fiziologia InimiiDocument42 paginiFiziologia InimiiflorinagramaÎncă nu există evaluări
- Cazuri Clinice Curăsp 1Document80 paginiCazuri Clinice Curăsp 1ANNA CarausÎncă nu există evaluări
- Sistemul CardiovascularDocument23 paginiSistemul CardiovasculararianamarÎncă nu există evaluări
- CV9-Hemodinamica 2016Document30 paginiCV9-Hemodinamica 2016Caranda BogdanÎncă nu există evaluări
- Boli Genetice MitocondrialeDocument28 paginiBoli Genetice MitocondrialeDorina Buimistru100% (2)
- Licenta FinalaDocument50 paginiLicenta FinalaJianu Georgian100% (1)
- Fiziopatologia HTADocument12 paginiFiziopatologia HTAdeealoryÎncă nu există evaluări
- Defibrilarea InimiiDocument9 paginiDefibrilarea InimiikostykÎncă nu există evaluări
- 6 C Insuficienta Cardiaca CARTE MPDocument179 pagini6 C Insuficienta Cardiaca CARTE MPLuca AlexÎncă nu există evaluări
- Laborator 3 Principiile Electrocardiografiei - FinalDocument30 paginiLaborator 3 Principiile Electrocardiografiei - FinalPoprijevschi ValentinÎncă nu există evaluări
- Curs 4 FiziopatologieDocument3 paginiCurs 4 FiziopatologieMedeea MedeÎncă nu există evaluări
- Curs 02. Functionarea Ap Cardiovascular II 2021Document5 paginiCurs 02. Functionarea Ap Cardiovascular II 2021Vlad ȘtefanÎncă nu există evaluări
- Adaptarea Cardio-Vasculara in EfortDocument93 paginiAdaptarea Cardio-Vasculara in EfortAnonymous JyYVoUF100% (4)
- MecanismeleDocument4 paginiMecanismeleGentzucuÎncă nu există evaluări
- Curs 00 Fiziopatologia-Circulatiei-Cerebrale FinalDocument11 paginiCurs 00 Fiziopatologia-Circulatiei-Cerebrale FinaltimcarasÎncă nu există evaluări
- Pre Leger I Leto AteDocument321 paginiPre Leger I Leto Atelasena132Încă nu există evaluări
- Curs ACEMSC - Cap I Si II - LB - Rom.Document167 paginiCurs ACEMSC - Cap I Si II - LB - Rom.Oana SălăvăstruÎncă nu există evaluări
- 2 Atrii 2 Ventricule: Sistemul Circulator InimaDocument4 pagini2 Atrii 2 Ventricule: Sistemul Circulator InimaGeorgiana NeațăÎncă nu există evaluări
- Explorarea Sistemului CirculatorDocument206 paginiExplorarea Sistemului CirculatorPopa D. SilviuÎncă nu există evaluări
- Performanta Cardiaca Si MecanogrameleDocument9 paginiPerformanta Cardiaca Si MecanogrameleAna Maria BaleaÎncă nu există evaluări
- Dinamica Normal Si Patologica LCR. HidrocefaliiDocument7 paginiDinamica Normal Si Patologica LCR. HidrocefaliiAdrian GradinaruÎncă nu există evaluări
- Fiziologia - Sistemului - Cardiovascular md1Document88 paginiFiziologia - Sistemului - Cardiovascular md1Christina HurstÎncă nu există evaluări
- Cauzele morții în practica medicală: Ghid de tanatogeneză în boala COVID-19De la EverandCauzele morții în practica medicală: Ghid de tanatogeneză în boala COVID-19Evaluare: 5 din 5 stele5/5 (1)
- Microcirculația sanguină: Următoarea generație de asistență socialăDe la EverandMicrocirculația sanguină: Următoarea generație de asistență socialăÎncă nu există evaluări
- Caz Clinic 15 Semiologie Medicala 1 Sem 2Document5 paginiCaz Clinic 15 Semiologie Medicala 1 Sem 2bella17Încă nu există evaluări
- Fise de EvaluareDocument12 paginiFise de Evaluareapi-23601680150% (2)
- Îngrijirea PlăgilorDocument3 paginiÎngrijirea Plăgilorbella17Încă nu există evaluări
- Caz Clinic 16 Semiologie Medicala 1 Sem 2Document5 paginiCaz Clinic 16 Semiologie Medicala 1 Sem 2bella17Încă nu există evaluări
- AnatomieDocument245 paginiAnatomiebella17Încă nu există evaluări
- TOALETA BOLNAVILOR INCONŞTIENŢI ŞI COMATOŞI Asigurarea Igienei Corporale Bolnavul Va Fi Spălat În Fiecare Zi CompletDocument2 paginiTOALETA BOLNAVILOR INCONŞTIENŢI ŞI COMATOŞI Asigurarea Igienei Corporale Bolnavul Va Fi Spălat În Fiecare Zi Completbella17Încă nu există evaluări
- Îngrijirea PăruluiDocument2 paginiÎngrijirea Păruluibella17Încă nu există evaluări
- Ingrijirea Mucoasei NazaleDocument1 paginăIngrijirea Mucoasei Nazalebella17Încă nu există evaluări
- 02 LP PDFDocument10 pagini02 LP PDFbella17Încă nu există evaluări
- 04 LP PDFDocument7 pagini04 LP PDFbella17Încă nu există evaluări
- 01 LP PDFDocument5 pagini01 LP PDFbella17Încă nu există evaluări
- 03 LP PDFDocument4 pagini03 LP PDFbella17Încă nu există evaluări
- Ingrijirea UrechilorDocument1 paginăIngrijirea Urechilorbella17Încă nu există evaluări
- Escarele de DecubitDocument4 paginiEscarele de Decubitbella17Încă nu există evaluări
- Foaia de ObservatieDocument2 paginiFoaia de Observatiebella17Încă nu există evaluări
- 05 LPDocument9 pagini05 LPbella17Încă nu există evaluări
- Biochimie 2Document2 paginiBiochimie 2bella17Încă nu există evaluări
- Obstrucţia Căilor Aeriene La AdultDocument4 paginiObstrucţia Căilor Aeriene La Adultbella17Încă nu există evaluări
- SangeleDocument6 paginiSangelebella17Încă nu există evaluări
- Biochimie 3Document3 paginiBiochimie 3bella17Încă nu există evaluări
- Tesut MuscularDocument2 paginiTesut Muscularbella17Încă nu există evaluări
- Tema 2Document10 paginiTema 2bella17Încă nu există evaluări
- Tema 1Document6 paginiTema 1bella17Încă nu există evaluări
- Retentia Urinara Sau Ischiuria Reprezinta Incapacitatea Vezicii Urinare de ADocument1 paginăRetentia Urinara Sau Ischiuria Reprezinta Incapacitatea Vezicii Urinare de Abella17Încă nu există evaluări
- Infectia EdondonticaDocument3 paginiInfectia Edondonticabella17Încă nu există evaluări
- Retenţia Acută de UrinăDocument1 paginăRetenţia Acută de Urinăbella17Încă nu există evaluări
- Tema 2 ContinuareDocument6 paginiTema 2 Continuarebella17Încă nu există evaluări
- PARAPLEGIILEDocument1 paginăPARAPLEGIILEbella170% (1)
- Stresul PsihicDocument1 paginăStresul PsihicMorar DanielÎncă nu există evaluări