Documente Academic
Documente Profesional
Documente Cultură
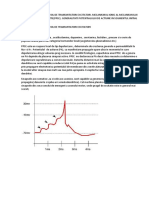
Tema 8 - Biofizica
Încărcat de
Roxana DănăilăDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Tema 8 - Biofizica
Încărcat de
Roxana DănăilăDrepturi de autor:
Formate disponibile
Tema VIII – Biofizica - Difuziunea si Osmoza
A. Influenta factorilor fizici asupra ratei de difuziune
Difuziunea este procesul prin care moleculele unui fluid patrund printre
moleculele altui fluid (aer/apa) datorita agitatiei termice. Rata de difuziune se
calculeaza cu ajutorul legii lui Fick:
dc
Φ = −DS , unde:
dx
Φ – fluxul moleculelor transportate pasiv
D – distanta
S – suprafata membranei
Dc/dx – sensul gradientului de concentratie
Osmoza – este un caz particular al difuziunii, printr-o membrana semi
permeabila (prin care pot trece numai unele molecule), care este permeabila pentru
solvent si nepermeabila pentru solvit.
Presiunea osmotica = presiunea (fictiva) ce ar trebui exercitata asupra solutiei
pentru a o aduce in echilibru cu solventul pur: po = pgh
Trebuie retinut ca NU exista presiune osmotica in lipsa membranei!
Legile Osmozei
𝐶
Cantitativa (Legea lui Pfeffer) 𝑝𝑜 = 𝑘 𝑇, unde:
𝑀
k – constanta
C – concentratia ponderala a solutiei (g/l)
M – masa molara a solvitului
T – temperatura absoluta
Daca notam cu n nr de moli dizolvati in volumul V de solutie, vom avea:
𝐶 𝑛
= = 𝑚, unde m reprezinta concentratia molara (moli/unitate de volum).
𝑀 𝑉
𝑛
Asa vom putea deduce Legea lui Van’t Hoff, scrisa 𝑝𝑜 = 𝑘 𝑇 = 𝑚𝑘𝑇 sau
𝑉
po V = nRT , unde R va fi constanta universala a gazelor
Se spune ca 2 solutii A si B sunt izotone una fata de cealalta daca intre ele nu
ar exista flux de solvit prin membrana. In cazul in care exista, una poate fi considerata
hipertona fata de cealalta (de exemplu A are presiune osmotica mai mare decat B) si
hipotona (B are presiune osmotica mai mica decat A).
Solutii false si solutii adevarate
Legile osmozei nu se aplcia riguros la toate categoriile de solutii pentru solutiile
concentrate, valoarea fiind mai mare decat cea calculata conform legilor osmozei
deoarece la concentratii mari, volumul moleculelor inceteaza de a mai fi neglijabil.
De asemenea, ca urmare a disociatiei electrolitilor, acizii si bazele au o
presiune osmotica mai mare decat calculata, deoarece moleculele disociaza, iar
numarul de elemente pe volum creste. In cazul agregatelor coloidale, situatia este
invers.
Astfel avem:
Solutii adevarate – numarul moleculelor dizolvate = numarului de particule
Solutii false – sunt cele cristaloide electrolite si coloidale
Calculul presiunii osmotice:
No – nr de moli de masa molara Mo
N1, n2,...., ni – nr de moli soliviti de masa molara M1, M2,..., Mi
V – volumul solutiei
Vo – volumul molar al solventului
Vi – volumul molar al solvitului
1) Concentratie molara = nr moli solvit / unitate de volum (aditiva)
𝑛𝑖 𝑛𝑖
𝑐𝑖 = =
𝑉 ∑ 𝑛𝑖 𝑉𝑖
2) Molalitate (osmolalitate) = nr moli solvit /unitate de masa de solvent (aditiva)
𝑛𝑖
𝑚𝑖 = ∗ 1000
𝑛0 𝑀0
unde noMo = masa solventului, in grame
3) Concentratia ponderala = masa de solvit/volum de solutie (neaditiva)
𝑝𝑖 𝑀𝑖 𝑝𝑖
𝑝𝑖 = , relatia cu concentratia molara va fi: 𝑐𝑖 =
𝑉 𝑀𝑖
Osmolul = particula oarecare din solutie a carei miscare libera dezordonata
este asimilabila unei molecule de gaz.
Osmolaritatea totala a unei solutii este asadar suma numarului de moli
nedisociati si a numarului de ioni-gram pe litru de solutie.
Aplicatii medicale
Majoritatea transporturilor membranare se realizeaza pasiv, prin osmoza, ceea
ce duce la necesitatea unui echilibru intre presiunile osmotice intracelulare si
extracelulare. Lichidele biologice au in mod normal osmolaritati ~300mOsm/L.
Variatii ale acestei valori pot determina stari hiperosmolare (produse de cresterea
unor elemente solvite, ca Na+, glucoza in sange) ce duc la deshidratare su stari
hipoosmolare, in cazul Na+ din sange, intoxicatiei cu apa, ce poate duce la hemoliza
eritrocitelor.
B. Metoda celor doua mcrometre pentru masurarea
dimensiunilor celulare
Microscopul optic: Este format din:
Partea optica – sistem de iluminare + 2 sisteme de lentile convergente
Sistemul obiectiv – un sistem centrat de lentile sub un tub metalic montat la
partea inferioara a microscopului prin sistemul revolver (marire x10-x90)
Sistemul ocular – sistem de lentile situate la partea superioara a tubului, cu o
putere de marire de x5-x15
Sistemul de iluminare – un bec situat inferior/oglinda sau ambele
Partea mecanica – serveste la sustinerea partii optice si a obiectului examinat
Puterea maritoare – produsul dintre puterile maritoare a sistemului obiectiv si
sistemul ocular
Principalele marimi caracteristice:
Puterea de rezolutie = capacitatea unui sistem optic de a separa 2 puncte
apropiate astfel incat ele sa fie percepute distinct la nivelul imaginii finale. Ea este
invers proportionala cu distanta minima intre doua puncte: P=1/ε, iar
1,22𝜆
𝜀=
2𝑛 𝑠𝑖𝑛𝑢
- λ – lungimea de unda a luminii utilizate la microscop
- n – indicele de refractie al mediului prin care trece lumina
- u – ½ conului luminos ce cade pe obiectiv
C. Evaluarea cantitativa a fenomenului de osmoza
a) La nivelul celulelor vegetale
Celulele animale mai prezinta pe langa membrana un perete celular semirigid,
ce limiteaza expansiunea citoplasmei dat englobarii apei de al exterior.
In mediul hipoosmotic, apa intra in celula, marind vacuola si implicit volumul
citoplasmatic. Celula se „umfla” si apare starea de turgescenta, starea de hidratare
optima.
In mediul hiperosmotic, apa iese din celula in vederea restabilirii izotoniei
mediilor. Celula isi micsoreaza volumul, fenomen numit plasmoliza, membrana
celulara fiind restransa si desprinsa de peretele celular.
b) La nivelul celulelor animale
La om, lipsa unui perete rigid care se limiteze marirea celulei duce la ruperea
membranei celulare in cazul hipotoniei mediului.
In mediul hipotonic, apa intra in celula si cauzeaza hemoliza prin fisurarea
membranei celulare. Hemolglobina este eliminata la exterior si ramane o structura
numita”fantoma eritrocitara”
In mediul hipertonic, apa va iesi din celula, cauzand retatinarea celulei
(incretirea acesteia) datorita restrangerii membranei.
S-ar putea să vă placă și
- Fenomene OsmoticeDocument4 paginiFenomene OsmoticeStelian CebanasÎncă nu există evaluări
- Referat 3Document4 paginiReferat 3Silviu BalanÎncă nu există evaluări
- Tot 2 Tema 2 Compartimente Lichidiene Intrebarea 4 de RevazutDocument26 paginiTot 2 Tema 2 Compartimente Lichidiene Intrebarea 4 de RevazutJannaGarazÎncă nu există evaluări
- Sinteza AGDocument71 paginiSinteza AGvictorasaurasÎncă nu există evaluări
- Totalizare 1Document30 paginiTotalizare 1Charlie McdonnellÎncă nu există evaluări
- Membrane - Biofizica Medicina DentaraDocument12 paginiMembrane - Biofizica Medicina DentaraMiruna Alexandra DimaÎncă nu există evaluări
- Tema 4Document68 paginiTema 4Elena PavlicÎncă nu există evaluări
- 6.saliva-Proprietati Si FunctiiDocument1 pagină6.saliva-Proprietati Si Functiiababa137Încă nu există evaluări
- Dosarul Genei PahDocument2 paginiDosarul Genei PahIon Catan100% (1)
- Fiziologia Membranei CelulareDocument29 paginiFiziologia Membranei CelulareCondrea100% (1)
- Analizatorul VizualDocument4 paginiAnalizatorul VizualCrainic CosminÎncă nu există evaluări
- Curs BiofizicaDocument72 paginiCurs BiofizicaSilviu Balan100% (1)
- 7 - Electrocutare. ToxicoDocument14 pagini7 - Electrocutare. ToxicoCristian MihailescuÎncă nu există evaluări
- Fiziologia Sistemului Nervos Autonom (Vegetativ)Document27 paginiFiziologia Sistemului Nervos Autonom (Vegetativ)Zmeu CristinaÎncă nu există evaluări
- Totalizare NR 3Document14 paginiTotalizare NR 3Mihaela CecanÎncă nu există evaluări
- APARATUL DIGESTIVAparatul Digestiv Este Format DintrDocument9 paginiAPARATUL DIGESTIVAparatul Digestiv Este Format DintrSuzana SoozyÎncă nu există evaluări
- ELABORAREA METODICĂ NR 1Document3 paginiELABORAREA METODICĂ NR 1Lena CorjÎncă nu există evaluări
- Fenomene de TransferDocument23 paginiFenomene de TransferStancioiuBalaciLauraÎncă nu există evaluări
- Metabolism Acizi NucleiciDocument34 paginiMetabolism Acizi NucleiciVerra DevonaÎncă nu există evaluări
- Tot 1 OdontoDocument5 paginiTot 1 OdontoMihaelaÎncă nu există evaluări
- LIPOZOMIDocument11 paginiLIPOZOMIRoberta StoicaÎncă nu există evaluări
- Curs 01 AterosclerozaDocument10 paginiCurs 01 AterosclerozaJulia MihaiÎncă nu există evaluări
- Cap IIIDocument22 paginiCap IIICezara PanainteÎncă nu există evaluări
- Elaborarea Metodică Nr.3Document13 paginiElaborarea Metodică Nr.3Ojog100% (2)
- 06 LipideDocument26 pagini06 LipideAnca GuțuÎncă nu există evaluări
- Morfologia ParodontiuluiDocument4 paginiMorfologia ParodontiuluiVadim JurjiuÎncă nu există evaluări
- Totalizare 1Document10 paginiTotalizare 1Caldari Pavel100% (1)
- Calea Acidului GlucuronicDocument1 paginăCalea Acidului GlucuronicfarmacologieÎncă nu există evaluări
- Prevenirea Bolii ParodontaleDocument5 paginiPrevenirea Bolii ParodontaleOprisor Andrei RobertoÎncă nu există evaluări
- Elaborarea Metodica nr13Document6 paginiElaborarea Metodica nr13Ana Maria BulatÎncă nu există evaluări
- Gene UmaneDocument47 paginiGene UmaneMariana ChetroiÎncă nu există evaluări
- EchilibrulDocument25 paginiEchilibrulRussu DumitruÎncă nu există evaluări
- Remedii de Actiune Asupra Fifeitor Sisteme Si MecanismeDocument2 paginiRemedii de Actiune Asupra Fifeitor Sisteme Si Mecanismefanea_viorelÎncă nu există evaluări
- Indicatie Metodica NR 3Document6 paginiIndicatie Metodica NR 3Josanu DomnicaÎncă nu există evaluări
- BIOCHIMIA PROCESULUI DE FORMARE A DIN+óILORDocument22 paginiBIOCHIMIA PROCESULUI DE FORMARE A DIN+óILORteodora100% (1)
- Planul Seminarelor La Bioet Stom 2020-2021-18381Document4 paginiPlanul Seminarelor La Bioet Stom 2020-2021-18381studentÎncă nu există evaluări
- Farm Modific2Document3 paginiFarm Modific2Ilie CebanÎncă nu există evaluări
- Curs Fiziologie An I Medicina - Secretia SalivaraDocument9 paginiCurs Fiziologie An I Medicina - Secretia SalivaraRaluca GeambazuÎncă nu există evaluări
- BiologieDocument20 paginiBiologiePaula CristianaÎncă nu există evaluări
- Subiecte Histologie Sem2 1Document160 paginiSubiecte Histologie Sem2 1Marina MaziluÎncă nu există evaluări
- EpinefrinaDocument12 paginiEpinefrinaNadia BadacăÎncă nu există evaluări
- Doar Pentru Studenţii de La USMFDocument1 paginăDoar Pentru Studenţii de La USMFtaniusha_usmfÎncă nu există evaluări
- Curs 4 - Principiile AdeziuniiDocument39 paginiCurs 4 - Principiile AdeziuniiTheodora CorinaÎncă nu există evaluări
- Tema 7. Metodele Clinico-Fiziologice de Cercetare A Activităţii CardiaceDocument6 paginiTema 7. Metodele Clinico-Fiziologice de Cercetare A Activităţii CardiaceAlexandra MagaleasÎncă nu există evaluări
- Biofizica 1Document5 paginiBiofizica 1Lavinia NicolaeÎncă nu există evaluări
- Biologie Celulara SubiecteDocument11 paginiBiologie Celulara Subiectedorofteim100% (1)
- 4Document2 pagini4pzdtskblÎncă nu există evaluări
- Microbiologie Cs RedactatDocument24 paginiMicrobiologie Cs RedactatАлександра БантушÎncă nu există evaluări
- 112 Artera Carotida ComunaDocument13 pagini112 Artera Carotida Comunaval362Încă nu există evaluări
- Muschii CapuluiDocument9 paginiMuschii Capuluiolea123Încă nu există evaluări
- Patologia Nervului OpticDocument27 paginiPatologia Nervului OpticAida MarinescuÎncă nu există evaluări
- Igiena TotDocument25 paginiIgiena TotDaniel GrigoroiuÎncă nu există evaluări
- Examen BMDocument34 paginiExamen BMVirginia ChirutacÎncă nu există evaluări
- 1anatomie 1 26Document21 pagini1anatomie 1 26ambulat100% (1)
- Referat 3Document4 paginiReferat 3TGÎncă nu există evaluări
- Curs 5Document6 paginiCurs 5Iulia PascuÎncă nu există evaluări
- Presiunea OsmoticăDocument11 paginiPresiunea OsmoticăOlesea Cosoi0% (1)
- Lucrarea 2 Descrierea Fenomenelor de Difuzie Ci Osmozc2a6aDocument21 paginiLucrarea 2 Descrierea Fenomenelor de Difuzie Ci Osmozc2a6aVerginia Shugani100% (2)
- Fenomene Moleculare de TransportDocument35 paginiFenomene Moleculare de TransportFlaviu TomuțaÎncă nu există evaluări
- Fenomene de TransportDocument10 paginiFenomene de TransportVoineta Gheorghiu100% (1)
- Poluarea Aerului - 2020Document40 paginiPoluarea Aerului - 2020Roxana DănăilăÎncă nu există evaluări
- Fractura Si TratamentDocument5 paginiFractura Si TratamentGeorgiana CiobanuÎncă nu există evaluări
- Igiena Modificate 2019 1 PDFDocument16 paginiIgiena Modificate 2019 1 PDFIulian Gherasim100% (1)
- AmandinaDocument4 paginiAmandinaRoxana DănăilăÎncă nu există evaluări
- Alba Ca ZapadaDocument2 paginiAlba Ca ZapadaRoxana DănăilăÎncă nu există evaluări
- Lista Admisi TAXADocument9 paginiLista Admisi TAXACătălin Pircus100% (1)
- Investigatii ParacliniceDocument36 paginiInvestigatii ParacliniceRoxana DănăilăÎncă nu există evaluări
- RX Studenti PlamanDocument39 paginiRX Studenti PlamanIrina AdrianaÎncă nu există evaluări
- Subiectemg IgienaDocument3 paginiSubiectemg IgienaCarciuc DragosÎncă nu există evaluări
- Nota Informativa AlimentatieDocument2 paginiNota Informativa AlimentatieRoxana DănăilăÎncă nu există evaluări
- CD Leziuni Elementare - OsDocument42 paginiCD Leziuni Elementare - OsStefanÎncă nu există evaluări
- Intoxicat ºia Alimentara ÅDocument3 paginiIntoxicat ºia Alimentara ÅRoxana DănăilăÎncă nu există evaluări
- Introducere PDFDocument3 paginiIntroducere PDFRoxana DănăilăÎncă nu există evaluări
- Intoxicat ºia Alimentara ÅDocument3 paginiIntoxicat ºia Alimentara ÅRoxana DănăilăÎncă nu există evaluări
- GenutuDocument2 paginiGenutuRoxana DănăilăÎncă nu există evaluări
- Nota Informativa AlimentatieDocument2 paginiNota Informativa AlimentatieRoxana DănăilăÎncă nu există evaluări
- Subiectemg IgienaDocument3 paginiSubiectemg IgienaCarciuc DragosÎncă nu există evaluări
- Alergii AlimentareDocument20 paginiAlergii AlimentareRoxana DănăilăÎncă nu există evaluări
- ZăvoiDocument2 paginiZăvoiRoxana DănăilăÎncă nu există evaluări
- Nota Informativa AerDocument1 paginăNota Informativa AerRoxana DănăilăÎncă nu există evaluări
- Alergii AlimentareDocument20 paginiAlergii AlimentareRoxana DănăilăÎncă nu există evaluări
- ClaudiaDocument2 paginiClaudiaRoxana DănăilăÎncă nu există evaluări
- Acordul PacientuluiDocument2 paginiAcordul PacientuluiRoxana DănăilăÎncă nu există evaluări
- SoranaDocument2 paginiSoranaRoxana DănăilăÎncă nu există evaluări
- Uro LogieDocument3 paginiUro LogieTeona PopaÎncă nu există evaluări
- Ekg PatologicaDocument151 paginiEkg PatologicaHucay EduardÎncă nu există evaluări
- Ortopedie Traumatologie PDFDocument4 paginiOrtopedie Traumatologie PDFTeona PopaÎncă nu există evaluări
- Anatomia Topografica A Mâinii Florea IrinaDocument58 paginiAnatomia Topografica A Mâinii Florea IrinaIrina Florea100% (4)
- Statii Agentii Bilete Internationale RO NoiembrieDocument2 paginiStatii Agentii Bilete Internationale RO NoiembrieRoxana DănăilăÎncă nu există evaluări
- Insuficienta Cardiaca AcutaDocument32 paginiInsuficienta Cardiaca AcutaMarcu StefanÎncă nu există evaluări