Documente Academic
Documente Profesional
Documente Cultură
Cromatografia. Electroforeza Proteinelor Plasmatice
Încărcat de
MirelaNagit0 evaluări0% au considerat acest document util (0 voturi)
141 vizualizări3 paginiTitlu original
Cromatografia. Electroforeza proteinelor plasmatice..doc
Drepturi de autor
© © All Rights Reserved
Formate disponibile
DOC, PDF, TXT sau citiți online pe Scribd
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca DOC, PDF, TXT sau citiți online pe Scribd
0 evaluări0% au considerat acest document util (0 voturi)
141 vizualizări3 paginiCromatografia. Electroforeza Proteinelor Plasmatice
Încărcat de
MirelaNagitDrepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca DOC, PDF, TXT sau citiți online pe Scribd
Sunteți pe pagina 1din 3
Tehnici de investigare utilizate in laboratorul clinic
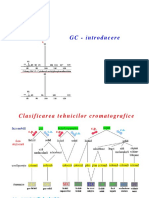
Cromatografia
Cromatografia este o metoda care permite izolarea, purificarea si separarea compusilor
din lumea vie. Tehnicile cromatografice implica separarea moleculelor pe baza
diferentelor in marime, masa, sarcina electrica, solubilitate si a proprietatilor de absorbtie.
Termenul de cromatografie (chromatos = culoare) a fost pentru prima data utilizat de
botanistul rus M. Tswett (1903) pentru a descrie separarea pigmentilor colorati din plante
pe o coloana de aluminiu.
Toate tipurile de cromatografie implica aceleasi trei componente si anume: amestecul de
separate, faza stationara si faza mobila (solventul). Faza stationara poate fi un solid, un
lichid pe un support solid sau un gel si ea poate umple o coloana, poate fi intinsa ca un
strat sau ca un film. Faza mobila poate fi ungaz sau un lichid.
Tipuri de cromatografie:
1) cromatografia pe hartie – permite separarea componentelor unui amestec pe baza
coeficientului de partitie (definit ca raportul dintre concentratia compusului in faza
stationara si concentratia aceluiasi compus in faza mobila, la echilibru) intre o faza
apoasa stationara (de regula, hartia Whatman) si faza mobila (un amestec de solventi
organici). Vor migra mai mult acei componenti ai amestecului care sunt mai solubili in
faza mobila si mai putin cei ai caror solubilitate este mai mare in faza stationara. Raportul
dintre distanta parcursa de fiecare component al amestecului si distanta parcursa de
solvent este valoarea Rf (Retention factor) a acelui component. Valoarea Rf este
dependenta de coeficientul de partitie al fiecarui component.
Cromatografia pe hartie poate fi:
a) ascendenta – foaia de hartie este plasata pe un suport si extremitatea inferioara este in
contact cu un rezervor in care se afla faza mobila. Solventul parcurge ascendent hartia,
prin capilaritate.
b) descendenta – solventul parcurge descendent hartia
c) bidimensionala – amestecul este separat initial intr-un prim sistem apoi, dupa uscare,
hartia este intoarsa cu 90 si separarea se realizeaza intr-un al doilea sistem
2) cromatografia pe strat subtire – foloseste placi, cu suporturile dorite, furnizate de
firme specializate. Solutia care contine proba se introduce pe placa cu ajutorul unui tub
capilar. Pentru control pe marginile placii se pune o proba martor care avand o
compozitie cunoscuta va avea valori Rf intr-un domeniu convenabil.
3) cromatografia de schimb ionic – presupune stabilirea unor legaturi ionice intre
sarcinile electrice ale moleculelor ionizate din amestecul de separat si sarcinile electrice
de semn contrar al rasinii schimbatoare de ioni cu care este umpluta coloana (faza
stationara). Anioni (de exemplu: -SO3-) sau cationi (de exemplu: -N(CH3)3+) sunt
covalent atasati la rasina din faza stationara. Faza mobila se numeste eluent, iar
componenta care a parasit coloana eluat. Separarea componentelor amestecului cu
ajutorul fazei mobile si scoaterea din coloana se numeste eluare.
4) cromatografia de excludere moleculara (gel-filtrarea) – are la baza dimensiunea
diferita a moleculleor din amestec. Gelul cu care este umpluta colana reprezinta “o sita
moleculara” care permite o deplasare diferentiala a moleculelor prin gel, in functie de
marimea lor. Moleculele mici pot difuza in lichidul din interiorul particulelor de gel si
astfel, in eluat apar intai moleculele de dimensiuni mari si doar mai tarziu cele cu
dimensiuni mici.
5) cromatografia de afinitate – pe coloana pot fi atasati covalent de o rasina insolubila
compusi cu mare afinitate (de exemplu: proteinele au mare afinitate pentru substratele
lor). Astfel, intr-un amestec de componenti eluati prin rasina o anumita proteina va putea
fi separata prin intarzierea ei selective pe coloana.
6) Cromatografia de inalta performanta in faza lichida (High Performance Liquid
Chromatography; HPLC) – este o metoda de separare care prezinta o mare putere de
rezolutie si reproductibilitate. Coloana de obicei are dimensiuni mici (10-30 cm lungime
si diametrul de 2-5 mm). Cu cat granulele sunt mai mici si mai strans impachetate, cu atat
rezolutia acestei tehnici este mai mare. Materialul ce umple coloana este atat de dens,
incat solutia trebuie pompata prin coloana cromatografica sub presiune mare (se folosesc
coloane de metal). Printre aplicatiile principale ale tehnicii HPLC amintim determinarea
cantitativa si calitativa din analizele farmaceutice, clinice, toxicologice, de mediu si
industriale.
Electroforeza
Electroforeza, originar demonstrata de catre Tiselius in 1937, este o metoda de analiza ce
permite separarea componentilor unui amestec pe baza diferentelor intre vitezele de
migrare in camp electric. Viteza de migrare a unei particule in camp electric este direct
proportionala cu sarcina si intensitatea campului electric si invers proportionala cu raza
particulei si vascozitatea mediului.
Componentele necesare electroforezei sunt:
a) aparatul de electroforeza alcatuit din: electrozi, un dispozitiv suport al mediului de
migrare si doua compartimente care contin solutie tampon
b) sursa de current continuu (5-8 V/cm). La valori ale intensitatii mai mari de 10 V/cm
incalzirea produsa poate determina pierderea apei din sistem prin evaporare si/sau
denaturarea unor probe
c) proba de analizat (aminoacizi, peptide, proteine, acizi nucleici)
d) solutia tampon – alegerea solutiei tampon este extrem de importanta pentru o buna
separare electroforetica. Componentele acestuia nu trebuie sa interactioneze cu compusii
probei, iar pH-ul trebuie astfel ales incat sa nu determine modificarea chimica sau
denaturarea probei. La pH<pI, molecula va fi cation si se va deplasa spre catod (-). La
pH>pI, molecula este anion si va migra spre anod (+). La pH=pI, sarcina globala va fi
nula si molecula nu migreaza in camp electric.
e) suportul – printre suporturile mai folosite se numara: hartia de filtru, acetatul de
celuloza, gelurile (gelul de agaroza, de amidon, de poliacrilamida, etc). Toate gelurile
sunt insolubile in apa si se prepara inainte de utilizare. Au proprietatea de “sita
moleculara”, ceea ce permite separari de molecule cu incarcari similare, dar forme si
marimi diferite.
f) reactivul de culoare. Cele mai multe probe sunt incolore si trebuie tratate cu reactivi
specifici determinand aparitia unor compusi colorati (pentru proteine se foloseste albastru
de bromfenol, pentru lipoproteine – Sudan Black, pentru acizi nucleici – bromura de
etidiu). Dupa colorare, excesul de colorant este indepartat din support prin elutie cu un
solvent potrivit.
Tipuri de electroforeza:
1. electroforeza pe hartie – aplicatiile acestei electroforeze sunt limitate datorita
adsorbtiei moleculelor amestecului de separate
2. electroforeza pe gel de agaroza (polimer polizaharidic). Metoda este folosita pentru
separarea proteinelor plasmatice si a acizilor nucleici
3. electroforeza pe gel de amidon, acetat de celuloza
4. electroforeza pe gele de poliacrilamida in prezenta de dodecil-sulfat de sodium (SDS-
PAGE) – se foloseste pentru separarea amestecurilor de proteine in functie de masele lor
moleculare. Gelul de poliacrilamida se prepara prin polimerizarea acrilamidei in prezenta
unor mici cantitati de agent de reticulare – metilen-bis-acrilamida care va realiza legaturi
incrucisate intre lanturi. Astfel, spre deosebire de celelalte geluri, dimensiunea gelului de
poliacrilamida poate fi precis controlata. Marimea ochiurilor retelei formate depinde de
concentratia agentului de reticulare. Separarea depinde atat de sarcina electrica cat si de
marimea si forma moleculei. De asemenea, se mai foloseste un initiator de polimerizare
(persulfatul de amoniu) si un agent ce induce o polimerizare regulata (TEMED =
tetrametiletilendiamida).
Dodecil-sulfatul de sodiu (CH3-(CH2)11-OSO3-Na+) este un detergent anionic, cu caracter
amfipatic care, pe de o parte, realizeaza denaturarea proteinelor, iar pe de alta parte
produce o incarcare negativa constanta pe unitatea de masa (fiecare gram de proteina
leaga aproximativ 1.4 g detergent). Moleculele proteice mari vor lega mai mult detergent
decat cele mici, dobandind o sarcina negativa mai mare. Astfel, supuse electroforezei
toate proteinele vor migra spre anod, indifferent de caracteristicile lor initiale.
5. focalizarea izoelectrica – permite separarea macromoleculelor in functie de punctele
izoelectrice
6. izotachoforeza – toti ionii ce urmeaza sa fie separati migreaza (phorezis) cu aceeasi
(izo) viteza (tacho). Metoda este folosita in industrie, in controlul poluarii, a depistarii
ionilor anorganici sau detergentilor din apa potabila, sau in controlul alimentelor,
medicamentelor.
7. imunoelectroforeza – este o metoda ce permite identificarea componentelor dintr-un
amestec antigenic. Dupa realizarea unei electroforeze standard (pe gel de agaroza, acetat
de celuloza) antiserul este plasat in gel de unde anticorpii se vor deplasa spre fractiunile
proteice. La locul de intaknire antigen – anticorp se formeaza linii sau arcuri de
precipitare.
S-ar putea să vă placă și
- Cromatografia Si ElectroforezaDocument6 paginiCromatografia Si Electroforezadan491450% (2)
- Explorare Functie HepaticaDocument56 paginiExplorare Functie HepaticaMaya GabrielaÎncă nu există evaluări
- Determinarea Vitezei de Sedimentare A Hematiilor (VSHDocument7 paginiDeterminarea Vitezei de Sedimentare A Hematiilor (VSHDan SmarandoiÎncă nu există evaluări
- Determinarea Factorului RHDocument3 paginiDeterminarea Factorului RHOtilia CohalÎncă nu există evaluări
- 2016 - Taus - Teste de Toxicologie ClinicaDocument229 pagini2016 - Taus - Teste de Toxicologie ClinicaAnonymous IOrWuyVQS1Încă nu există evaluări
- Biochimie LP SubiecteDocument12 paginiBiochimie LP SubiecteNicoleta SavaÎncă nu există evaluări
- Biochimie - LPDocument46 paginiBiochimie - LPAfrodita22Încă nu există evaluări
- RSD Biochimie PT StudentiDocument82 paginiRSD Biochimie PT StudentiCiuban Cosmin Cozo100% (1)
- 11.STEROIDE AlcaloiziDocument43 pagini11.STEROIDE Alcaloizipopa anaÎncă nu există evaluări
- Subiecte Biochimie LP 2Document21 paginiSubiecte Biochimie LP 2CristiÎncă nu există evaluări
- Proteine Plasmatice Curs PuDocument9 paginiProteine Plasmatice Curs PuGabrielaÎncă nu există evaluări
- Intoxicatie FenobarbitalDocument4 paginiIntoxicatie FenobarbitalSorin TrocaruÎncă nu există evaluări
- Ghid de Utilizare Pentra DX NexusDocument17 paginiGhid de Utilizare Pentra DX NexusCristina Lidia StefanÎncă nu există evaluări
- Parametri CromatograficiDocument141 paginiParametri CromatograficiElena TrofinÎncă nu există evaluări
- pulsoximetriаDocument19 paginipulsoximetriаMazurencoIanaÎncă nu există evaluări
- Metabolismul Protidic: Determinarea Proteinelor Totale Din Lichidele Biologice La EcvineDocument13 paginiMetabolismul Protidic: Determinarea Proteinelor Totale Din Lichidele Biologice La EcvineAlina VulpeÎncă nu există evaluări
- Examenul-Segmentului-Anterior ModificatDocument14 paginiExamenul-Segmentului-Anterior ModificatCosminÎncă nu există evaluări
- Citometria in FluxDocument4 paginiCitometria in FluxRopopa100% (1)
- LP 11 - Hemostaza PrimaraDocument6 paginiLP 11 - Hemostaza PrimaraPetronela MateoiuÎncă nu există evaluări
- Examen Grila - Medicina Generala - Genetica - An II2Document6 paginiExamen Grila - Medicina Generala - Genetica - An II2Maria Diana RuginăÎncă nu există evaluări
- Curs 5-6-IHCDocument62 paginiCurs 5-6-IHCAnCa DinuÎncă nu există evaluări
- Caracterizarea Produselor Cosmetice Si Farmaceutice Prin HPLCDocument5 paginiCaracterizarea Produselor Cosmetice Si Farmaceutice Prin HPLCAlexandra IoanaÎncă nu există evaluări
- Lab6b Tehnica Western BlotDocument5 paginiLab6b Tehnica Western BlotEugenia Ciumac100% (1)
- Reactii Imune PatologiceDocument7 paginiReactii Imune PatologiceAlexandra NăsuiÎncă nu există evaluări
- Curs 1 Facultate 16.10.2014Document33 paginiCurs 1 Facultate 16.10.2014Ioana-Mihaela TomaÎncă nu există evaluări
- Carte Microbiologie1Document32 paginiCarte Microbiologie1Inaam BaraziÎncă nu există evaluări
- Electroforeza HBDocument6 paginiElectroforeza HBLuisa Maria UrecheÎncă nu există evaluări
- Curs 3 ECDocument92 paginiCurs 3 ECAnca Paraschiv100% (1)
- Curs 11 Grupe SanguineDocument4 paginiCurs 11 Grupe SanguineElena Caranica100% (1)
- TesteDocument3 paginiTesteViolina CîmpanuÎncă nu există evaluări
- RenalDocument37 paginiRenalCristina-Alexandra ConstantinÎncă nu există evaluări
- 63343478-Hemograma pdf1Document26 pagini63343478-Hemograma pdf1Alexuta MariaÎncă nu există evaluări
- Explorarea HemostazeiDocument51 paginiExplorarea Hemostazeianidale100% (1)
- Hiv SidaDocument3 paginiHiv Sidadoc buc100% (1)
- Titrare ConductometricaDocument2 paginiTitrare Conductometricaiionel97100% (1)
- Calcule Acid Salicilic (LP 10-11) - Grupa 1Document6 paginiCalcule Acid Salicilic (LP 10-11) - Grupa 1Cristian-Catalin GavatÎncă nu există evaluări
- 07 Aplicatii Practice in Lab de BiochimieDocument39 pagini07 Aplicatii Practice in Lab de BiochimieEnache CristinaÎncă nu există evaluări
- Explorarea HemostazeiDocument11 paginiExplorarea Hemostazeiandreeagrig714Încă nu există evaluări
- Imunoglobulinele (Ii)Document25 paginiImunoglobulinele (Ii)C. IoanaÎncă nu există evaluări
- Curs 18 Imunologie - Toleranta ImunologicaDocument10 paginiCurs 18 Imunologie - Toleranta ImunologicaCipi TÎncă nu există evaluări
- Fib Rino GenDocument6 paginiFib Rino GenSpircă Ioana-AndreeaÎncă nu există evaluări
- Citometrie in FluxDocument11 paginiCitometrie in FluxMaria Luiza CraciunÎncă nu există evaluări
- CURSUL 3 - AB Familii de Antibiotice Si BetalactamineDocument49 paginiCURSUL 3 - AB Familii de Antibiotice Si BetalactamineAlina Adriana DorceaÎncă nu există evaluări
- ImunologieDocument9 paginiImunologieDragoş BogdanÎncă nu există evaluări
- Electroforeza CapilaraDocument12 paginiElectroforeza Capilaragiagia120786100% (1)
- Teste ImunologiceDocument3 paginiTeste ImunologiceDianaÎncă nu există evaluări
- Metode de Determinare A Testelor de Biochimie GeneralaDocument5 paginiMetode de Determinare A Testelor de Biochimie Generaladiana_qmmcÎncă nu există evaluări
- Histologie SangeleDocument11 paginiHistologie Sangeleiulia-uroÎncă nu există evaluări
- EritrociteDocument11 paginiEritrociteTrestian SebastianÎncă nu există evaluări
- HemogramaDocument38 paginiHemogramacristinaÎncă nu există evaluări
- Subiecte Partea 2 2Document30 paginiSubiecte Partea 2 2Ludmila BugaÎncă nu există evaluări
- Cuprins Compendiu de HematologieDocument1 paginăCuprins Compendiu de Hematologiediddi21100% (1)
- Identificarea Proteinelor Prin Western BlottingDocument9 paginiIdentificarea Proteinelor Prin Western Blottingcipry123100% (1)
- Teste Totalizarea 3Document6 paginiTeste Totalizarea 3ZugravPetruSiDinaÎncă nu există evaluări
- PCN-202 Starile Hipertensive in SarcinaDocument40 paginiPCN-202 Starile Hipertensive in SarcinaElena CataragaÎncă nu există evaluări
- Cromatografie ElectroforezaDocument13 paginiCromatografie ElectroforezaELA-MARIA CODIȚĂ-SÎRBUÎncă nu există evaluări
- Spectometria IR - Metode Electroforetice - Cuplajul On-LineDocument5 paginiSpectometria IR - Metode Electroforetice - Cuplajul On-LineLoredana IordacheÎncă nu există evaluări
- HPTLCDocument14 paginiHPTLCIovanescu AlexÎncă nu există evaluări
- Exemple de PhmetreDocument10 paginiExemple de PhmetreCarmen Giorgiana CretuÎncă nu există evaluări
- COLOIZI-Cromatogr Pe HartieDocument9 paginiCOLOIZI-Cromatogr Pe Hartiealex_andra_22Încă nu există evaluări
- Cerere Pentru Registrul Unic de ControlDocument1 paginăCerere Pentru Registrul Unic de ControlC.NicoÎncă nu există evaluări
- APROBDocument2 paginiAPROBMirelaNagitÎncă nu există evaluări
- Avc Ischemic - GeneralitatiDocument24 paginiAvc Ischemic - GeneralitatiValentin Bogdan Vfb100% (3)
- Carte de Povesti PDFDocument0 paginiCarte de Povesti PDFRemus RusuÎncă nu există evaluări
- Cerere Pentru Registrul Unic de ControlDocument1 paginăCerere Pentru Registrul Unic de ControlC.NicoÎncă nu există evaluări
- 7 Informare Tarife 2022Document10 pagini7 Informare Tarife 2022MirelaNagitÎncă nu există evaluări
- Scala BarthelDocument2 paginiScala BarthelDiana Apetri90% (10)
- LP Hipoglicemie FMAM 2017Document15 paginiLP Hipoglicemie FMAM 2017MirelaNagitÎncă nu există evaluări
- Insuficienţa CardiacDocument15 paginiInsuficienţa CardiacMirelaNagitÎncă nu există evaluări
- 01 Apa WebDocument9 pagini01 Apa WebMaria FlorentinaÎncă nu există evaluări
- Lipide FMAM 2017Document38 paginiLipide FMAM 2017MirelaNagitÎncă nu există evaluări
- 5 VitamineleDocument29 pagini5 VitamineleMirelaNagitÎncă nu există evaluări
- Lipide FMAM 2017Document38 paginiLipide FMAM 2017MirelaNagitÎncă nu există evaluări
- Acid Folic - Varianta 3Document3 paginiAcid Folic - Varianta 3MirelaNagitÎncă nu există evaluări
- Enzimele PlasmaticeDocument11 paginiEnzimele PlasmaticeRuben Beniamin GhidanacÎncă nu există evaluări
- 5 VitamineleDocument21 pagini5 VitamineleNicky_9435044Încă nu există evaluări
- Hemoproteine. FierulDocument4 paginiHemoproteine. FierulMirelaNagitÎncă nu există evaluări
- Reglarea Glicemiei. Parametrii Metabolismului GlucidicDocument3 paginiReglarea Glicemiei. Parametrii Metabolismului GlucidicMirelaNagitÎncă nu există evaluări
- Tabel MuschiDocument14 paginiTabel MuschiAlina Elena50% (2)
- Reglarea Glicemiei. Parametrii Metabolismului GlucidicDocument2 paginiReglarea Glicemiei. Parametrii Metabolismului GlucidicMirelaNagitÎncă nu există evaluări
- PHul SolutiilorDocument4 paginiPHul SolutiilorMirelaNagitÎncă nu există evaluări
- Catabolismul Hemului. Bilirubina.Document5 paginiCatabolismul Hemului. Bilirubina.Vasilache AlinaÎncă nu există evaluări
- Kine To Tera PiaDocument2 paginiKine To Tera PiaMirelaNagitÎncă nu există evaluări
- Elena Avramescu - Bazele Anatomice Ale MiscariiDocument108 paginiElena Avramescu - Bazele Anatomice Ale Miscariiiri0100% (10)
- CURS 2 Si 3 BFKT 2016 PDFDocument45 paginiCURS 2 Si 3 BFKT 2016 PDFMirelaNagit0% (1)
- Tehnici CursDocument109 paginiTehnici CursYarik BotnarÎncă nu există evaluări
- Asistare in RecuperareDocument120 paginiAsistare in RecuperareMirelaNagitÎncă nu există evaluări
- Carte KinetoterapieDocument258 paginiCarte Kinetoterapiealexandra_m100% (8)
- Curs Aminoacizi PeptideDocument53 paginiCurs Aminoacizi PeptideBellaBabaÎncă nu există evaluări